题目内容
 完成下列各小题的计算
完成下列各小题的计算(1)16g胆矾固体溶于水,配成100ml溶液,其物质的量浓度是
(2)7.8g过氧化钠溶于足量水中放出氧气,反应完毕后电子转移
(3)把NaHCO3与Na2CO3?10H2O的混合物6.56g溶于水配制成100ml溶液,已知此溶液中Na+的物质的量浓度为:c(Na+)=0.5mol?L-1,如果将6.56g混合物加热到恒重,残留物的质量是
(4)镁铝合金5.1g溶于足量盐酸中充分反应,标准状况下放出气体体积为5.6L,则合金中金属铝的质量是
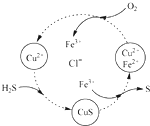
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示.反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为
考点:化学方程式的有关计算,氧化还原反应的计算
专题:
分析:(1)根据n=
计算16g胆矾的物质的量,再根据c=
计算硫酸铜溶液的浓度;
(2)根据n=
计算过氧化钠的物质的量,过氧化钠中氧元素化合价为-1价,0.1mol过氧化钠与二氧化碳完全反应生成0.05mol氧气;
(3)固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量;
(4)镁铝合金与盐酸发生:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,设合金中Mg为xmol,Al为ymol,根据二者质量之和与生成氢气的体积列方程,据此解答;
(5)该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等.
| m |
| M |
| n |
| V |
(2)根据n=
| m |
| M |
(3)固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量;
(4)镁铝合金与盐酸发生:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,设合金中Mg为xmol,Al为ymol,根据二者质量之和与生成氢气的体积列方程,据此解答;
(5)该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等.
解答:
解:(1)16g胆矾的物质的量=
=0.064mol,故硫酸铜溶液的浓度为
=0.64mol/L,故答案为:0.64;
(2)7.8g过氧化钠的物质的量为
=0.1mol,与足量二氧化碳反应生成0.05mol氧气,转移了0.1mol电子,故答案为:0.1;
(3)100mL溶液中c(Na+)=0.5mol?L-1,则n(Na+)=0.1L×0.5mol?L-1=0.05mol,
固体混合物加热至恒重时,剩余固体为Na2CO3,由钠元素守恒,则n(Na2CO3)=
=0.025mol,m(Na2CO3)=0.025mol×106g/mol=2.65g,
故答案为:2.65;
(4)设合金中Mg为xmol,Al为ymol,则:
Mg+2HCl=MgCl2+H2↑
xmol xmol
2Al+6HCl=2AlCl3+3H2↑,
ymol 1.5ymol
由题意可知,
解得x=0.1,y=0.1,
则Al的质量=0.1mol×27g/mol=2.7g,
故答案为:2.7;
(5)H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=
=0.5mol,
故答案为:0.5mol.
| 16g |
| 250g/mol |
| 0.064mol |
| 0.1L |
(2)7.8g过氧化钠的物质的量为
| 7.8g |
| 78g/mol |
(3)100mL溶液中c(Na+)=0.5mol?L-1,则n(Na+)=0.1L×0.5mol?L-1=0.05mol,
固体混合物加热至恒重时,剩余固体为Na2CO3,由钠元素守恒,则n(Na2CO3)=
| 0.05mol |
| 2 |
故答案为:2.65;
(4)设合金中Mg为xmol,Al为ymol,则:
Mg+2HCl=MgCl2+H2↑
xmol xmol
2Al+6HCl=2AlCl3+3H2↑,
ymol 1.5ymol
由题意可知,
|
解得x=0.1,y=0.1,
则Al的质量=0.1mol×27g/mol=2.7g,
故答案为:2.7;
(5)H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=
| 1mol |
| 2 |
故答案为:0.5mol.
点评:本题考查了根据化学方程式的计算,中等难度,注意原子守恒和得失电子守恒的利用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作中正确的是( )
| A、蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸 |
| B、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C、焰色反应每次实验都要先用稀硫酸洗净铂丝 |
| D、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 |
关于物质的变化、性质及用途,下列叙述中正确的是( )
| A、化学变化中有化学键的断裂与生成,并伴有能量的变化,物理变化二者都不具备 |
| B、简单非金属阴离子只有还原性,而简单金属阳离子只有氧化性 |
| C、工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
V L浓度为1.000 mol?L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
| A、通入标准状况下的HCl气体22.4V L |
| B、将溶液加热浓缩到0.5V L |
| C、加入10.00 mol?L-1的盐酸0.2V L,再稀释至1.5V L |
| D、加入V L 3 mol?L-1的盐酸混合均匀 |
下列说法或表示方法中正确的是( )
| A、等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2 |
| B、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C、在25℃、101 kPa时,1克H2完全燃烧生成H2O放出热量142.9kJ.2H2O(1)=2H2(g)+O2(g)△H=-571.6kJ?mol-1 |
| D、稀的强酸和稀的强碱溶液反应的热化学方程式均为:H++OH-=H2O△H=-57.3kJ?mol-1 |
下列说法中正确的是( )
| A、金属阳离子一定只具有氧化性 |
| B、金属单质作反应物时一定不是氧化剂 |
| C、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| D、氧化还原反应中的反应物,不是氧化剂就是还原剂 |
 按要求完成下列小题.
按要求完成下列小题.