题目内容
某温度下,向 2.0L 恒容密闭容器中充入 1.0 molA 和 1.0 molB,发生反应 A(g)+B(g)?C(g)△H<0,经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是.
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/moL | 1 | 0.8 | 0.75 | 0.70 | 0.70 |
| A、反应在前 5s 的平均速率v (A)=0.04mol?L-1 |
| B、相同温度下,若平衡后再向容器中充入 0.5 mol A 和 0.5 mol C,反应再次达到平衡前v (正)>v (逆) |
| C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,反应再次达到平衡时 c(C)小于 0.075 mol?L-1 |
| D、相同温度下,若起始时向容器中充入 2.0 mol C,达到平衡时,C 的转化率大于 70% |
考点:化学平衡的计算,化学平衡建立的过程
专题:化学平衡专题
分析:依据化学平衡三段式列式计算;
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
A、依据V(A)=
计算;
B、计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向;
C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,相当于移走一半反应物,利用先缩小再扩大的方法判断;
D、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,据此判断.
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
A、依据V(A)=
| △c |
| △t |
B、计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向;
C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,相当于移走一半反应物,利用先缩小再扩大的方法判断;
D、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,据此判断.
解答:
解:A的物质的量达到0.70mol反应达到平衡状态,则
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.30 0.30 0.30
平衡量(mol) 0.70 0.70 0.30
K=
=1.22
A、反应在前5s的平均速率v(A)=
=0.02mol?L-1?s-1 ,故A错误;
B、相同温度下,若平衡后再向容器中充入 0.5 mol A 和 0.5 mol C,Qc=
=0.19<K,反应正向进行,反应达到平衡前v(正)>v(逆),故B正确;
C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,相当于移走一半反应物,那先将体积缩小一半,则平衡状态和原来一样,cC(C)=0.15 mol?L-1,再扩大到原来的体积,如果平衡不移动则Cc(C)=0.075 mol?L-1,但事实扩大时相当于缩小压强平衡向逆方向移动,Cc(C)<0.075 mol?L-1,故C正确;
D、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.4mol,C的物质的量大于0.6mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.6mol,参加反应的C的物质的量小于1.4mol,转化率小于70%,故D错误;
故选BC.
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.30 0.30 0.30
平衡量(mol) 0.70 0.70 0.30
K=
| ||||
|
A、反应在前5s的平均速率v(A)=
| ||
| 5s |
B、相同温度下,若平衡后再向容器中充入 0.5 mol A 和 0.5 mol C,Qc=
| ||||
|
C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,相当于移走一半反应物,那先将体积缩小一半,则平衡状态和原来一样,cC(C)=0.15 mol?L-1,再扩大到原来的体积,如果平衡不移动则Cc(C)=0.075 mol?L-1,但事实扩大时相当于缩小压强平衡向逆方向移动,Cc(C)<0.075 mol?L-1,故C正确;
D、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.4mol,C的物质的量大于0.6mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.6mol,参加反应的C的物质的量小于1.4mol,转化率小于70%,故D错误;
故选BC.
点评:本题考查了化学平衡计算应用,化学反应速率计算,平衡常数的计算分析应用是解题关键,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据表中数据,下列判断正确的是( )
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |
已知:2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ/mol.实验室测得在密闭容器中放入4mol SO2和足量O2发生上述化学反应时放出314.3kJ热量,SO2的转化率最接近于( )
| A、40% | B、50% |
| C、80% | D、90% |
一定条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)?CH3OH(g),若开始时只充入a mol CH3OH蒸气,达到平衡时,混合物的压强比起始时增大了70%;若开始时充入a mol CO和2a mol H2的混合气体,达到平衡时H2的转化率为( )
| A、30% | B、35% |
| C、65% | D、70% |
下列药品的归类不正确的是( )
| A、NaOH--腐蚀品 |
| B、乙醇--易燃液体 |
| C、浓H2SO4--爆炸品 |
| D、CH4--易燃气体 |
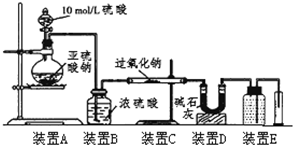 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.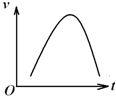 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.