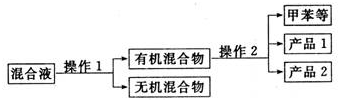
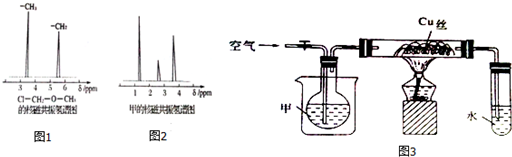
题目内容
18.研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2 NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )| A. | 潮湿的氯气通过盛有浓H2SO4的洗气瓶 | |
| B. | 硫化氢通入浓H2SO4中 | |
| C. | 浓H2SO4滴入萤石中,加热 | |
| D. | 加入少量H2SO4使乙酸乙酯水解 |
分析 反应①中二氧化氮作反应物时化合价的降低,但在整个硫酸型酸雨的形成反应过程中,二氧化氮先是消耗,最后是生成,可以判断所起的作用为催化剂作用,以此来解答.
解答 解:①SO2+NO2=SO3+NO,该反应二氧化氮中氮元素的化合价降低,所以二氧化氮作氧化剂;
将方程式①×2+②+③得方程式为:2SO2+H2O+O2=SO3+H2SO4,所以二氧化氮在整个反应过程中起催化剂的作用.
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶,浓硫酸作干燥剂,故A错误;
B.硫化氢通入浓H2SO4中,浓硫酸能氧化硫化氢气体,浓硫酸作氧化剂,故B错误;
C.浓H2SO4滴入萤石(CaF2)中,加热制取HF,是利用强酸制取弱酸,故C错误;
D.乙酸乙酯水解时加入H2SO4,硫酸作催化剂,故D正确;
故选D.
点评 本题以信息的形式考查物质的性质,侧重氧化还原反应及催化剂的考查,注意信息中整个反应的分析为解答的关键,不能偏面以①中化合价变化分析,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
6.下列过程中△H小于零的是( )
| A. | 炽热的碳与二氧化碳的反应 | B. | 氯化铵分解得氨气 | ||
| C. | 碳酸钙分解得二氧化碳 | D. | Zn与硫酸的反应 |
3. 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 增大压强,平衡向正反应方向移动 |
10.下列说法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| B. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g)△H=-1256 kJ•mol-1,可知乙炔的燃烧热为1256 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
7.图I 是NO2(g)+CO(g)?CO2(g)+NO(g)反应过程中能量变化的示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图II所示.

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量 | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
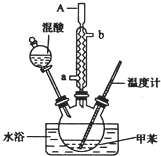 一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
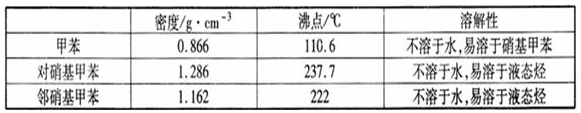
 .
.