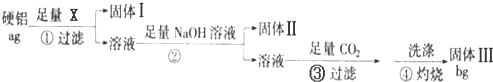
题目内容
向质量分数为2a%,体积为10mL,物质的量浓度为c1mol/L的稀H2SO4中加入VmL的水,使之质量分数变为a%,此时物质的量浓度为c2mol/L,则下列关系正确的是( )
| A、V<10 2c2=c1 |
| B、V>10 2c2=c1 |
| C、V>10 2c2<c1 |
| D、V>10 2c2>c1 |
考点:物质的量浓度的相关计算
专题:计算题
分析:假设质量分数为2a%的硫酸溶液密度为Dg/mL,质量分数为a%的硫酸溶液密度为dg/mL,硫酸溶液密度大于水的密度,且硫酸溶液的浓度越大密度越大,故D>d>ρ(水).
稀释过程中溶质的H2SO4质量不变,用D表示出质量分数为2a%,体积为10mL的硫酸溶液质量,结合质量分数计算稀释后溶液的质量,进而计算水的质量,再根据V=
计算水的体积,结合D>ρ(水)判断;
根据c=
表示出c1、c2,结合D>d进行判断.
稀释过程中溶质的H2SO4质量不变,用D表示出质量分数为2a%,体积为10mL的硫酸溶液质量,结合质量分数计算稀释后溶液的质量,进而计算水的质量,再根据V=
| m |
| ρ |
根据c=
| 1000ρω |
| M |
解答:
解:假设质量分数为2a%的硫酸溶液密度为Dg/mL,质量分数为a%的硫酸溶液密度为dg/mL,硫酸溶液密度大于水的密度,且硫酸溶液的浓度越大密度越大,故D>d>ρ(水).
稀释过程中溶质的H2SO4质量不变,故稀释后溶液质量为
g=20Dg,故加入水的质量为20dg-10Dg=10Dg,加入水的体积V=
=
mL,由于D>ρ(水),故V=
mL>10mL;
根据c=
可知,c1=
,c2=
,由于D>d,故2c2<c1,
故选C.
稀释过程中溶质的H2SO4质量不变,故稀释后溶液质量为
| 10×D×2a% |
| a% |
| 10Dg |
| ρ水g/mL |
| 10D |
| ρ水 |
| 10D |
| ρ水 |
根据c=
| 1000ρω |
| M |
| 1000D×2a% |
| 98 |
| 1000d×a% |
| 98 |
故选C.
点评:本题考查物质的量浓度、质量分数有关计算,难度中等,注意理解掌握物质的量浓度与质量分数之间的关系,明确硫酸反应浓度越大密度越大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列说法正确的是( )
| A、可用加热的方法除去混在碳酸氢钠固体中的碳酸钠固体 |
| B、除去CO中少量的O2,可将混合气体通过灼热的Cu网 |
| C、向某溶液中加入盐酸,产生使澄清石灰水变浑浊的气体,该溶液中可能含有HCO3- |
| D、向某溶液中加入盐酸酸化的BaCl2溶液有白色沉淀,该溶液中一定含有SO42- |
下列现象不能用“相似相溶规则”原理解释的是( )
| A、氯化氢易溶于水 |
| B、氯气易溶于氢氧化钠溶液 |
| C、碘易溶于四氯化碳 |
| D、碘难溶于水 |
下列说法不正确的是( )
| A、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| B、形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体 |
| C、欲提高氯水中HClO的浓度可往氯水加适量的碳酸钙粉末 |
| D、大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物 |
下列图示对应的装置以及操作均正确的是( )
A、 定容 |
B、 钠的焰色反应 |
C、 蒸馏 |
D、 蒸发 |
在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物主要是( )
| A、Fe2S3、I2、S |
| B、Al(OH)3、I2、S |
| C、Fe(OH)3、Al(OH)3、S |
| D、FeS、S、Al(OH)3 |
某固体化合物A不导电,但熔化或溶于水都能完全电离.下列关于物质A的说法中,正确的是( )
| A、A为非电解质 |
| B、A为强电解质 |
| C、A既不是电解质也不是非电解持 |
| D、A为弱电解质 |
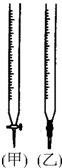 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下: