题目内容
下列说法不正确的是( )
| A、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| B、形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体 |
| C、欲提高氯水中HClO的浓度可往氯水加适量的碳酸钙粉末 |
| D、大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物 |
考点:常见的生活环境的污染及治理,硅和二氧化硅
专题:化学应用
分析:A.水晶的成分是二氧化硅;
B.酸雨与N、S的氧化物有关,温室效应与二氧化碳有关;
C.氯水中盐酸与碳酸钙反应,可使氯气与水的化学平衡正向移动;
D.N2
NO,NO
NO2,NO
硝酸,FeS2
SO2.
B.酸雨与N、S的氧化物有关,温室效应与二氧化碳有关;
C.氯水中盐酸与碳酸钙反应,可使氯气与水的化学平衡正向移动;
D.N2
| 放电 |
| O2 |
| O2 |
| O2、H2O |
| O2 |
解答:
解:A.水晶项链成分是二氧化硅的晶体,餐桌上的瓷盘是硅酸盐制品,故A错误;
B.形成酸雨的氧化物主要是SO2和氮的氧化物,与水反应生成酸使pH<5.6;温室效应与二氧化碳有关,使全球温度升高,故B正确;
C.氯水中盐酸与碳酸钙反应,可使氯气与水的化学平衡正向移动,则提高氯水中HClO的浓度可往氯水中加适量的碳酸钙粉末,故C正确;
D.由N2
NO,NO
NO2,NO
硝酸,FeS2
SO2,可知,大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物,故D正确;
故选A.
B.形成酸雨的氧化物主要是SO2和氮的氧化物,与水反应生成酸使pH<5.6;温室效应与二氧化碳有关,使全球温度升高,故B正确;
C.氯水中盐酸与碳酸钙反应,可使氯气与水的化学平衡正向移动,则提高氯水中HClO的浓度可往氯水中加适量的碳酸钙粉末,故C正确;
D.由N2
| 放电 |
| O2 |
| O2 |
| O2、H2O |
| O2 |
故选A.
点评:本题考查物质的性质,综合考查元素化合物知识,为高频考点,把握物质的性质、化学反应原理为解答的关键,注意发生的反应及环境污染问题,综合性较强,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
在相同温度下,可逆反应X(g)+Y(g)?2Z(g),在四个体积相等的密闭容器内按下列配比进行反应,达到平衡时,Y的含量最低的是( )
| A、a mol X+a mol Y |
| B、2a mol Z |
| C、a mol X+a mol Z |
| D、a mol Y+a mol Z |
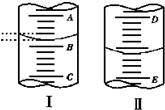 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )| A、Ⅰ中是3.2 mL,Ⅱ中是3.40 mL |
| B、Ⅰ中是4.8 mL,Ⅱ中是3.40 mL |
| C、Ⅰ中是3.2 mL,Ⅱ中是4.60 mL |
| D、Ⅰ中是4.8 mL,Ⅱ中是4.60 mL |
某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol铁,充分反应后产生的NO气体在标准状况下的体积为( )
| A、36L | B、22.4L |
| C、28L | D、11.2L |
向质量分数为2a%,体积为10mL,物质的量浓度为c1mol/L的稀H2SO4中加入VmL的水,使之质量分数变为a%,此时物质的量浓度为c2mol/L,则下列关系正确的是( )
| A、V<10 2c2=c1 |
| B、V>10 2c2=c1 |
| C、V>10 2c2<c1 |
| D、V>10 2c2>c1 |
下列关于氯水的叙述,正确的是( )
| A、新制的氯水中只含有Cl2和H2O分子 |
| B、新制的氯水可使蓝色石蕊试纸先变蓝后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后,pH值变小,漂白能力变弱 |
当溶液中有大量的H+和Ba2+时,下列离子中有可能大量存在的是( )
| A、SO42- |
| B、CO32- |
| C、Cl- |
| D、OH- |
根据以下反应判断:Fe3+、Fe2+、Cu2+的氧化性强弱顺序是( )
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
| A、Fe2+>Cu2+>Fe3+ |
| B、Fe3+>Fe2+>Cu2+ |
| C、Fe3+>Cu2+>Fe2+ |
| D、Cu2+>Fe2+>Fe3+ |