题目内容
19.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
分析 A.碳酸中碳酸根离子浓度最小,铵根离子促进了碳酸根离子的水解,则碳酸钠中碳酸根离子浓度最大,其次为碳酸铵;
B.根据混合液中的电荷守恒判断;
C.反应后溶质为等浓度的碳酸钠和碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-);
D.混合液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COOH)<c(CH3COO-),结合电荷守恒判断.
解答 解:A.等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3中,①中碳酸碳酸主要以第一步电离为主,其溶液中碳酸根离子浓度最小;②中碳酸钠电离出碳酸根离子,碳酸根离子的水解程度较小,其溶液在碳酸根离子浓度最大;③中碳酸氢根离子的电离程度较小,但是③中碳酸根离子浓度大于①;④中铵根离子水解促进了碳酸根离子的水解,所以c(CO32-)的大小关系为:②>④>③>①,故A正确;
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+2c( C2O42-),故B错误;
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液,反应后溶质为等浓度的碳酸钠和碳酸氢钠,由于碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),溶液中离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COOH)<c(CH3COO-),根据电荷守恒可知:c(CH3COOH)+c(OH-)<c(Na+)+c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,注意掌握判断离子浓度大小的方法,试题培养了学生的分析、理解能力及灵活应用能力.

| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| B. | 次氯酸分子的电子式: | |
| C. | 乙酸乙酯的结构简式: | |
| D. | Al(OH)3的电离:H++AlO2-+H2O?Al(OH)2?Al3++3OH- |
| A. | 闪电时,氮气与氧气反应 | B. | 合成氨反应 | ||
| C. | 用氨气合成尿素 | D. | 金属镁在氮气中燃烧生成Mg3N2 |

 ,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.
,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.

 的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式:
的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式: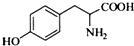 、
、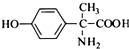 .
.