题目内容
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,甚至产生 NH+4.现有一定量铝粉和铁粉的混合物与一定体积某浓度 的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入 5mol?L-1的 NaOH溶液,所加 NaOH 溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,甚至产生 NH+4.现有一定量铝粉和铁粉的混合物与一定体积某浓度 的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入 5mol?L-1的 NaOH溶液,所加 NaOH 溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则 (1)B 与 A 的差值为
(2)写出 DE 段发生反应的离子方程
(3)原硝酸的物质的量是
(4)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为
考点:铝的化学性质,镁、铝的重要化合物,铁的化学性质
专题:几种重要的金属及其化合物
分析:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3?H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
(1)B 与 A 的差值为氢氧化铝的物质的量,计算EF段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
(2)由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应;
(3)根据N元素守恒计算硝酸的物质的量;
(4)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,n(Al)=0.05mol,根据电子转移守恒求得n(Fe)=0.03mol,据此求出混合物中铝粉与铁粉的物质的量之比.
(1)B 与 A 的差值为氢氧化铝的物质的量,计算EF段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
(2)由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应;
(3)根据N元素守恒计算硝酸的物质的量;
(4)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,n(Al)=0.05mol,根据电子转移守恒求得n(Fe)=0.03mol,据此求出混合物中铝粉与铁粉的物质的量之比.
解答:
解:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3?H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
(1)B 与 A 的差值为氢氧化铝的物质的量,计算EF段消耗的氢氧化钠,由图可知,EF段消耗的氢氧化钠溶液为104mL-94mL=10mL,故该阶段参加反应的氢氧化钠为0.01L×5mol/L=0.05mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.05mol,
故答案为:0.05;
(2)由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,NH4++OH-═NH3?H2O,
故答案为:NH4++OH-═NH3?H2O;
(3)由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,n(NH4NO3)=n(NH4+)=0.03mol,根据钠元素守恒,可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据氮元素守恒计算原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,
故答案为:0.5;
(4)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol,由图可知,DE段消耗的氢氧化钠的体积为94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3?H2O 可知,计算溶液中n(NH4+)=0.03ml,根据电子转移守恒有,3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,
故答案为:5:3.
(1)B 与 A 的差值为氢氧化铝的物质的量,计算EF段消耗的氢氧化钠,由图可知,EF段消耗的氢氧化钠溶液为104mL-94mL=10mL,故该阶段参加反应的氢氧化钠为0.01L×5mol/L=0.05mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.05mol,
故答案为:0.05;
(2)由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,NH4++OH-═NH3?H2O,
故答案为:NH4++OH-═NH3?H2O;
(3)由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,n(NH4NO3)=n(NH4+)=0.03mol,根据钠元素守恒,可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据氮元素守恒计算原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,
故答案为:0.5;
(4)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol,由图可知,DE段消耗的氢氧化钠的体积为94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3?H2O 可知,计算溶液中n(NH4+)=0.03ml,根据电子转移守恒有,3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,
故答案为:5:3.
点评:本题考查混合物的计算,题目难度较大,本题注意根据图象判断各阶段反应的情况,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后由图知继续加入氢氧化钠溶液,沉淀量不变,注意从质量守恒的角度结合反应的关系式计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③ |
| B、相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③ |
| C、常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度大小顺序为:c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-) |
| D、常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
下列反应的离子方程式正确的是( )
A、溶质物质的量相等的Ba(OH)2与KAl(SO4)2?12H2O溶液混合:Ba2++6OH-+2Al3++SO
| ||||
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | ||||
C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO
| ||||
D、将适量CO2通入Ca(ClO)2溶液中:2ClO-+CO2+H2O═CO
|
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.

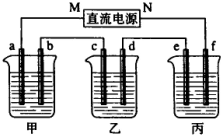 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题: