题目内容
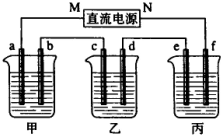 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:(1)电源的N端为
(2)电极b 上发生的电极反应为
(3)列式计算电极b上生成的气体在标状况下的体积
(4)电极c的质量变化是
考点:电解原理
专题:电化学专题
分析:乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极.丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×9.55%=(100-x)×10%,得x=4.5g,故为
=0.25mol.由方程式2H2O
2H2+O2 可知,消耗2molH2O,转移4mol电子,所以整个反应中转移电子为0.5mol,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的;
(1)根据以上分析判断正负极;
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,写出电极反应式;
(3)转移0.5mol电子,则生成O2为
=0.125mol,根据气体摩尔体积计算;
(4)Cu2++2e-=Cu,转移0.5mol电子,据此计算铜的质量.
| 4.5g |
| 18g/mol |
| ||
(1)根据以上分析判断正负极;
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,写出电极反应式;
(3)转移0.5mol电子,则生成O2为
| 0.5mol |
| 4 |
(4)Cu2++2e-=Cu,转移0.5mol电子,据此计算铜的质量.
解答:
解:(1)乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b-c移动,M是负极,N为正极,故答案为:正;
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×9.55%=(100-x)×10%,
得x=4.5g,故为
=0.25mol.由方程式2H2O
2H2+O2 可知,消耗2molH2O,转移4mol电子,所以整个反应中转移电子为0.5mol,
则生成O2为
=0.125mol,标况下的体积为0.125mol×22.4L/mol=2.8L;
故答案为:2.8L;
(4)整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e-=Cu,
可知转移0.5mol电子生成的m(Cu)=
mol×64g/mol=16g.
故答案为:16g.故答案为:16g;
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×9.55%=(100-x)×10%,
得x=4.5g,故为
| 4.5g |
| 18g/mol |
| ||
则生成O2为
| 0.5mol |
| 4 |
故答案为:2.8L;
(4)整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e-=Cu,
可知转移0.5mol电子生成的m(Cu)=
| 0.5 |
| 2 |
故答案为:16g.故答案为:16g;
点评:本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.

练习册系列答案
相关题目
亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中生成HClO2而发生分解,分解的化学方程式为5HClO2═4ClO2↑+HCl+2H2O,ClO2是广谱型消毒剂.下列说法正确的是( )
| A、HClO2是有机酸 |
| B、上述反应中,ClO2是氧化产物 |
| C、上述反应中,1mol HClO2分解转移2mol电子 |
| D、上述反应中,氧化剂与还原剂物质的量之比1:1 |
25℃时,水的离子积为Kw,该温度下将a mol?L-1一元酸HA与b mol?L-1一元强碱BOH等体积混合,若恰好完全中和,下列结论中不正确的是( )
A、混合液中:c(H+)≤
| ||
| B、混合液中:c(HA)+c(A-)=amol?L-1 | ||
| C、a=b | ||
| D、混合液中:c(H+)+c(B+)=c(OH-)+c(A-) |
化学与生活息息相关.下列说法不正确的是( )
| A、可用淀粉-KI试纸和食醋检验真假碘盐 |
| B、用饱和氯化铵溶液可以清洗金属表面的锈迹 |
| C、次氯酸钠溶液是生活中常用的消毒剂 |
| D、经常食用含明矾的食品能中和过多的胃酸 |
 (Ⅰ)已知四种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为:
(Ⅰ)已知四种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,甚至产生 NH+4.现有一定量铝粉和铁粉的混合物与一定体积某浓度 的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入 5mol?L-1的 NaOH溶液,所加 NaOH 溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,甚至产生 NH+4.现有一定量铝粉和铁粉的混合物与一定体积某浓度 的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入 5mol?L-1的 NaOH溶液,所加 NaOH 溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则 
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是