题目内容
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是
A.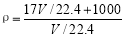 B.
B.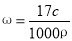
C. D.
D.
AD
【解析】
试题分析: 标准状况下VL 氨气溶解在1L水中,所得溶液的质量为 [(V/22.4)×17+1000]g,因此所得溶液的体积为{[(V/22.4)×17+1000]/ ρ},因此ρ=[17V∕22.4+1000]÷(溶液体积)而V/22.4是氨气的物质的量,A错误;根据ρ= 可得
可得 ,B正确;标准状况下VL氨气溶解在1L水中,所得溶液中溶质质量为(V/22.4)×17g,则所得溶液的质量分数为ω="[(V/22.4)×17]/[" [(V/22.4) ×17+1L×1000×1g/mL] =17V/(17V+22400),C正确;根据c =n/V(液) ,而V+1不是溶液的体积,D错误。
,B正确;标准状况下VL氨气溶解在1L水中,所得溶液中溶质质量为(V/22.4)×17g,则所得溶液的质量分数为ω="[(V/22.4)×17]/[" [(V/22.4) ×17+1L×1000×1g/mL] =17V/(17V+22400),C正确;根据c =n/V(液) ,而V+1不是溶液的体积,D错误。
考点:考查物质的量浓度的相关计算,溶质质量分数的简单计算。

| A、硅胶多孔,吸附水份能力强,所以常用作袋装食品的干燥剂 | B、“煤制油”是不可能实现的,“煤制油”属于伪科学 | C、烟气脱硫是防治酸雨的一种有效措施 | D、天然气属于高效清洁燃料 |
E~N等元素在周期表中的相对位置如下表。E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是
E |
|
|
| K |
F | G |
| M | L |
| H |
| N |
|
A.K的氢化物水溶液显碱性
B.F的单质与氧气反应只生成一种氧化物
C.H与N的原子核外电子数相差14
D.最高价氧化物的水化物酸性:K > L > M
(16分)Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式: 。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤 | 预期现象与结论 |
步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 |
; |
步骤2: ____________________________________ ____________________________________。 |
|
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:
取少量样品溶于水, 。

 物质
物质