题目内容
(17分)铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
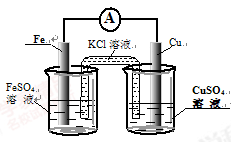
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。

②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
(17分)(1)Cu2++2H2O Cu(OH)2+2H+(2分);
Cu(OH)2+2H+(2分);
(2)(12分)①(见图,共4分,标对1个2分)
②CH4(2分) O2+4e-+2H2O(3分)13(3分);
(3)(3分)存在溶解平衡:FeS(s)  Fe 2+(aq)+ S 2-(aq)[1分],其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀[1分],使得上述溶解平衡继续向右移动 [1分]。[或用平衡FeS(s)+Cu2+(aq)= CuS(s)+ Fe 2+(aq)解释]
Fe 2+(aq)+ S 2-(aq)[1分],其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀[1分],使得上述溶解平衡继续向右移动 [1分]。[或用平衡FeS(s)+Cu2+(aq)= CuS(s)+ Fe 2+(aq)解释]
【解析】
试题分析:(1)CuSO4是强酸弱碱盐,Cu2+水解消耗水电离产生的OH-,产生Cu(OH)2使溶液显酸性,为了抑制盐的水解,所以要加入少量的硫酸,用方程式表示是Cu2++2H2O Cu(OH)2+2H+;(2)①根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,则Fe要插在FeSO4溶液中,Cu插在CuSO4溶液中,用图表示是
Cu(OH)2+2H+;(2)①根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,则Fe要插在FeSO4溶液中,Cu插在CuSO4溶液中,用图表示是 ;
;
②想在II中实现铁上镀铜,Fe应该作阴极,与电池的负极连接,则应在a处通入CH4;在b处通入空气,在b电极上发生的电极反应式为O2+4e-+2H2O =4OH-;若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,电解的方程式是:2NaCl+2H2O Cl2↑+H2↑+2NaOH,n(NaCl)=0.1mol,在阳极Cl-放电,若Cl-完全放电,应该产生气体0.05mol,而实际产生的气体的物质的量是n(气体)=0.448L÷22.4L/mol=0.02mol<0.05mol,说明Cl-没有反应完全。根据方程式可知:n(NaOH):n(Cl2)=2:1,n(Cl2)= 0.02mol,所以n(NaOH)=0.04mol,因此c(NaOH)= n(NaOH)÷V=0.04mol÷0.4L=0.1mol/L,所以c(H+)=Kw÷c(OH-)=1×10-13mol/L, pH=13;(3)当把FeS加入工业废水中后,FeS在水中溶解、电离,存在溶解平衡:FeS(s)
Cl2↑+H2↑+2NaOH,n(NaCl)=0.1mol,在阳极Cl-放电,若Cl-完全放电,应该产生气体0.05mol,而实际产生的气体的物质的量是n(气体)=0.448L÷22.4L/mol=0.02mol<0.05mol,说明Cl-没有反应完全。根据方程式可知:n(NaOH):n(Cl2)=2:1,n(Cl2)= 0.02mol,所以n(NaOH)=0.04mol,因此c(NaOH)= n(NaOH)÷V=0.04mol÷0.4L=0.1mol/L,所以c(H+)=Kw÷c(OH-)=1×10-13mol/L, pH=13;(3)当把FeS加入工业废水中后,FeS在水中溶解、电离,存在溶解平衡:FeS(s)  Fe 2+(aq)+ S 2-(aq),由于在溶液中存在Cu2+,而且c(Cu2+)·c(S 2-)>Ksp(CuS),所以其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
Fe 2+(aq)+ S 2-(aq),由于在溶液中存在Cu2+,而且c(Cu2+)·c(S 2-)>Ksp(CuS),所以其中的Cu2+与S 2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
考点:考查盐的水解、电化学反应原理的应用、溶液pH的计算、沉淀溶解平衡在处理废水的应用的知识。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案下列陈述I、 II正确并且有因果关系的是( )
选项 | 叙述I | 叙述II |
A | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
B | Ba(OH)2可与盐酸反应 | Ba(OH)2可用于治疗胃酸过多 |
C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
D | H2O2有氧化性 | H2O2能使酸性高锰酸钾溶液褪色 |
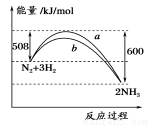
 ?2NH3,ΔH=-92 kJ/mol
?2NH3,ΔH=-92 kJ/mol


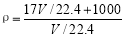 B.
B.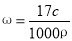
 D.
D.