题目内容
4.下列溶液中粒子的物质的量浓度关系正确的是( )| A. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中: c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 草酸钠(Na2C2O4)溶液中:c(OH-)=c(H+)+c(HC2O4)+c(H2C2O4) |
分析 A.反应后溶质为等浓度的醋酸、醋酸钠、氯化钠,醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH);
B.反应后溶质为硫酸钠、硫酸铵,铵根离子部分水解,溶液呈酸性;
C.氨水为弱碱,混合液中氨水过量,混合液呈碱性,则c(H+)<c(OH-),结合电荷守恒判断;
D.根据草酸钠溶液中的质子守恒判断.
解答 解:A.20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,反应后溶质为等浓度的醋酸、醋酸钠、氯化钠,醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH),根据物料守恒可知c(CH3COO-)>c(Cl-)>c(CH3COOH),溶液中离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故A错误;
B.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合,溶质为硫酸铵和硫酸钠,铵根离子发生水解,溶液呈酸性,则c(H+)>c(OH-),钠离子和硫酸根离子不水解,则c(Na+)=c(SO42-)>c(NH4+),溶液中离子浓度大小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.氨水为弱碱,则混合液中氨水过量,混合液呈碱性,则c(H+)<c(OH-),根据电荷守恒可知c(Cl-)<c(NH4+),所以正确的离子浓度关系为:c(Cl-)+c(H+)<c(NH4+ )+c(OH-),故C错误;
D.根据草酸钠(Na2C2O4)溶液中的质子守恒可得:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | CaCl2  | B. | Na2O  | C. | NaCl  | D. | H2O |
| A. | 同素异形体 | B. | 同分异构体 | C. | 同位素 | D. | 同一物质 |
| A. | 石墨晶体内既有共价键又有分子间作用力 | |
| B. | 石墨晶体熔沸点很高,硬度很大 | |
| C. | 石墨晶体内每个六边形平均含完整碳原子2个 | |
| D. | 石墨晶体中,每个C原子连接3个六元环 |
| A. | 图为丙烷的球棍模型: | B. | 某有机物的名称是:2,3二甲基戊烷 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | 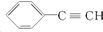 的最简式为:C4H3 的最简式为:C4H3 |
 .
. HN3+OH-.
HN3+OH-. ,
, 烃的含氧衍生物A是一种重要的有机合成中间体,分子式为C4H2O3,具有五元环结构.由A可以合成有机物E和高分子化合物G,有关物质的转化关系如图所示:
烃的含氧衍生物A是一种重要的有机合成中间体,分子式为C4H2O3,具有五元环结构.由A可以合成有机物E和高分子化合物G,有关物质的转化关系如图所示: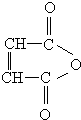 ,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.
,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.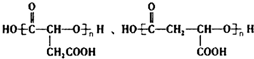 .
. ;
;