题目内容
9.叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O═NaN3+NaOH+NH3,3NaNH2+NaNO3═NaN3+3NaOH+NH3↑.回答下列问题:
(1)氮所在的周期中,电负性最大的元素是F,第一电离能最小的元素是Li.
(2)基态氮原子的L层电子排布图为
 .
.(3)与N3-互为等电子体的分子为N2O(写出一种).
(4)叠氮化钠(NaN3)中离子半径的大小关系是Na+<_N3-.叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:N3-+H2O
 HN3+OH-.
HN3+OH-.(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强.
(6)安全气囊的设计原理为6NaN3+Fe2O3$\frac{\underline{\;撞击\;}}{\;}$3Na2O+2Fe+9N2↑.
①氮分子中σ键和π键数目之比为1:2.
②铁在周期表的位置第四周期第Ⅷ族,铁的原子结构示意图为
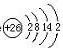 ,
,(7)氯化铬酰(CrO2Cl2)能与许多有机物反应,常作氧化剂或氯化剂,请回答下列问题.
①写出基态铬原子的电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中,最外层电子数与铬原子相同的元素有K、Cu(填元素符号),
②比较二者的电负性:As>Ga(填“<”、“>”或“=”).
分析 (1)同周期随原子序数增大元素电负性增大、元素的第一电离能呈增大趋势;
(2)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同;
(3)将1个N原子及1个单位负电荷用O原子替换,可得其等电子体;
(4)核外电子排布相同的离子,核电荷数越大离子半径越小,叠氮化钠的水溶液中N3-离子发生水解,破坏水的电离平衡,溶液呈碱性;
(5)根据氨气分子之间存在氢键分析解答;
(6)①氮分子结构式为N≡N,三键含有1σ键、2个π键;
②Fe位于周期第四周期第Ⅷ族;
(7)①Cr的原子序数为24,根据能量最低原理书写基态原子的电子排布式,根据最外层电子数为1判断;
②同周期元素从左到右电负性逐渐增大.
解答 解:(1)同周期随原子序数增大元素电负性增大、元素的第一电离能呈增大趋势,故氮所在的周期中,第二周期电负性最大的元素是F,第一电离能最小的元素是Li,
故答案为:F;Li;
(2)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同,故基态氮原子的L层电子排布图为: ,
,
故答案为: ;
;
(3)将1个N原子及1个单位负电荷用O原子替换,可得其等电子体为N2O等,
故答案为:N2O;
(4)核外电子排布相同的离子,核电荷数越大离子半径越小,离子半径的大小关系是Na+<N3-,;叠氮化钠的水溶液中N3-离子发生水解:N3-+H2O HN3+OH-,破坏水的电离平衡,溶液呈碱性,
HN3+OH-,破坏水的电离平衡,溶液呈碱性,
贵答案为:<;N3-+H2O HN3+OH-;
HN3+OH-;
(5)N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强,故氨气的沸点较高,
故答案为:N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强;
(6)①氮分子结构式为N≡N,三键含有1σ键、2个π键,氮分子中σ键和π键数目之比=1:2,故答案为:1:2;
②Fe位于周期第四周期第Ⅷ族,原子结构示意图为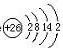 ,故答案为:第四周期第Ⅷ族;
,故答案为:第四周期第Ⅷ族;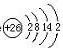 ;
;
(7)①Cr的原子序数为24,根据能量最低原理可知基态原子的电子排布式为1s22s22p63s23p63d54s1,
铬原子的最外层电子数为1,位于第四周期,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu,
故答案为:1s22s22p63s23p63d54s1; K、Cu;
②同周期元素从左到右电负性逐渐增大,可知电负性:As>Ga,故答案为:>.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析能力的考查,题目涉及电子排布式、分子的极性、杂化类型等知识,题目难度较大,注意相似相溶原理的应用.

| A. | Ca2+、Na+、NO3-、Fe2+ | B. | Ca2+、Na+、Fe3+、NO3- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Mg2+、Cl-、NH4+、SO42- |
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量的氢氧化钠残留在烧杯中 | |
| D. | 用带游码的托盘天平称2.4g氢氧化钠时误用了“左码右物”的操作 |
| A. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中: c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 草酸钠(Na2C2O4)溶液中:c(OH-)=c(H+)+c(HC2O4)+c(H2C2O4) |
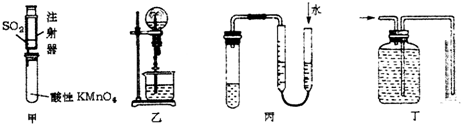
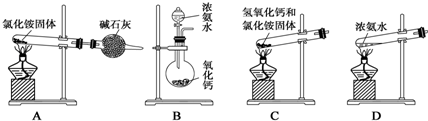
| A. | 可用甲装置来探究SO2的漂白性 | |
| B. | 可用乙装置验证HCl气体极易溶于水 | |
| C. | 用图示的方法可以检查丙装置的气密性 | |
| D. | 可用丁装置测量铜与稀硝酸反应生成气体的体积 |
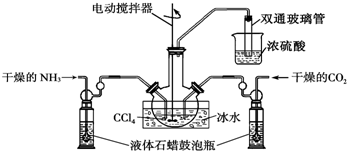
| A. | 2 mol | B. | 4mol | C. | 5mol | D. | 6mol |
| A. | 浓H2SO4增重的是CO2的质量 | B. | 该有机物中没有氧元素 | ||
| C. | 该有机物中有氧元素 | D. | 碱石灰增重的是CO2和H2O的质量 |
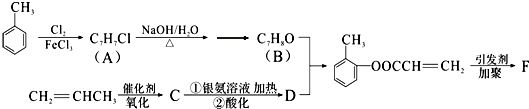
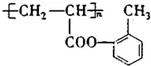
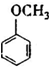 (填结构简式).
(填结构简式).