题目内容
8.下列热化学方程式书写正确的是( )| A. | SO2+O2$?_{加热}^{催化剂}$ 2SO 3△H=-196.6 kJ/mol | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O( l )△H=-285.8 kJ/mol | |
| C. | 2H2( g )+O2( g )═2H2O ( l )△H=+571.6 kJ/mol | |
| D. | C(s)+O2( g )═CO2(g)△H=+393.5 kJ/mol |
分析 A.没有标出物质的聚集状态;
B.H2与O2的化合反应为放热反应;
C.氢气的燃烧为放热反应;
D.C的燃烧为放热反应.
解答 解:A.没有标出物质的聚集状态,正确的写法为2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ/mol,故A错误;
B.H2与O2的化合反应为放热反应,符合热化学方程式的书写要求,故B正确;
C.氢气的燃烧为放热反应,正确的写法为2H2( g )+O2( g )═2H2O ( l )△H=-571.6 kJ/mol,故C错误;
D.C的燃烧为放热反应,正确的写法为C(s)+O2( g )═CO2(g)△H=-393.5 kJ/mol,故D错误.
故选B.
点评 本题考查热化学方程式的书写,题目难度不大,注意热化学方程式的书写注意事项.

练习册系列答案
相关题目
19.下列有关工业生产的叙述中错误的是( )
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
16.甲烷和氨在国民经济中占有重要地位.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
①反应热△H(填“>”、“<”或“=”)<0.
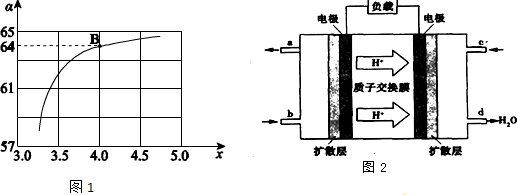
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.
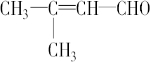
(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.

(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
3.下列离子方程式错误的是( )
| A. | 氯气通入水中:C12+H2O?H++C1-+HClO | |
| B. | 向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3+CaCO3↓+2H2O | |
| C. | 将适量的CO2通入Ca(C1O)2溶液中:Ca2++2C1O-+CO2+H2O═2HC1O+CaCO3↓ | |
| D. | Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
13.元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定.结合所学知识,判断下列反应中(反应条件略)正确的是( )
①Pb+2Cl2═PbCl4②Sn+2Cl2═SnCl4③SnCl2+Cl2═SnCl4
④PbO2+4HCl═PbCl4+2H2O⑤Pb3O4+8HCl═3PbCl2+Cl2↑+4H2O.
①Pb+2Cl2═PbCl4②Sn+2Cl2═SnCl4③SnCl2+Cl2═SnCl4
④PbO2+4HCl═PbCl4+2H2O⑤Pb3O4+8HCl═3PbCl2+Cl2↑+4H2O.
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①②④⑤ |
20.某溶液可使紫色石蕊溶液变红,向其中加人BaCl2溶液,有白色沉淀生成,该溶液中可能含有下列离子中的( )
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |
18.碳酸锰,俗称“锰白”,是生产电讯器材软磁铁氧体的原料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,工业上有广泛的用途.工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如图1:

已知:几种金属离子沉淀的pH如表回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC.
A.适当升高温度 B.适当增大压强
C.研磨矿石 D.加入大量的蒸馏水
(2)溶浸过程中发生的主要反应是:FeS2与MnO2在稀硫酸中反应生成Fe3+、Mn2+、SO42-和H2O.在该反应配平的离子方程式中,氧化剂前面的化学计量数为15.
(3)除铁工序中,①先加入软锰矿,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
②再加入石灰的目的是3.7~5.2.
(4)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(Fˉ)=0.01mol•L-1,滤液中残留c(Ca2+)=1.5×10ˉ6mol•L-1,则Ksp(CaF2)=1.5×10ˉ10(mol3•L-3).
(5)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液的pH、反应时间关系如图2所示.对比不同反应条件下的曲线,依据图中信息,你能获得的结论有:
①pH等于7.0时反应速率最快,且MnCO3产率最高;②pH越大越有利于提升MnCO3的产率.
(6)副产品A的主要成分是(NH4)2SO4.

已知:几种金属离子沉淀的pH如表回答下列问题:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
A.适当升高温度 B.适当增大压强
C.研磨矿石 D.加入大量的蒸馏水
(2)溶浸过程中发生的主要反应是:FeS2与MnO2在稀硫酸中反应生成Fe3+、Mn2+、SO42-和H2O.在该反应配平的离子方程式中,氧化剂前面的化学计量数为15.
(3)除铁工序中,①先加入软锰矿,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
②再加入石灰的目的是3.7~5.2.
(4)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(Fˉ)=0.01mol•L-1,滤液中残留c(Ca2+)=1.5×10ˉ6mol•L-1,则Ksp(CaF2)=1.5×10ˉ10(mol3•L-3).
(5)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液的pH、反应时间关系如图2所示.对比不同反应条件下的曲线,依据图中信息,你能获得的结论有:
①pH等于7.0时反应速率最快,且MnCO3产率最高;②pH越大越有利于提升MnCO3的产率.
(6)副产品A的主要成分是(NH4)2SO4.
 ;
; .
.