题目内容
18.有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得16.8g该有机物经燃烧生成44.0g CO2和14.4g水.质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-O-H和位于分子端的CCH,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1.(1)写出A的分子式C5H8O;
(2)写出A的结构简式
 ;
;(3)下列物质一定能与A发生反应的是abcd(填序号)
a.H2 b.Na c.KMnO4 d.Br2
(4)有机物B是A的同分异构体,1mol B可以与1mol Br2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1,则B的结构简式是
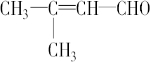 .
.
分析 (1)根据n=$\frac{m}{M}$计算有机物A、二氧化碳、水的物质的量,根据原子守恒计算烃分子中C、H原子数目,根据相对原子质量计算分子中氧原子数目,据此书写该烃的分子式;
(2)(3)红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,分子中有3种不同的H原子,原子数目之比为6:1:1,结合有机物的分子式判断有机物A的结构;
(3)根据有机物A含有是官能团进行分析解答;
(4)有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式书写.
解答 解:(1)有机物A只含有C、H、O三种元素,质谱图表明其相对分子质量为84,16.8g有机物A的物质的量=$\frac{16.8g}{84g/mol}$=0.2mol,经燃烧生成44.0g CO2,物质的量为1mol,生成14.4g H2O,物质的量为 $\frac{14.4g}{18g/mol}$=0.8mol,故有机物A分子中N(C)=$\frac{1mol×1}{0.2mol}$=5,N(H)=$\frac{0.8mol×2}{0.2mol}$=8,故N(O)=$\frac{84-12×5-8}{16}$=1,故A的分子式为C5H8O,
故答案为:C5H8O;
(2)不饱和度为:$\frac{2×5+2-8}{2}$=2,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个-OH连接在同一C原子上,所以A的结构简式为: ,
,
故答案为: ;
;
(3)红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,不饱和度为:$\frac{2×5+2-8}{2}$=2,不含其它官能团,含有羟基,能与钠反应,含有C≡C双键,能与酸性高锰酸钾发生氧化反应,能与溴发生加成反应,能与氢气发生加成反应,
故答案为:abcd;
(4)有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式可知,B中还含有-CHO,故B的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物分子式确定的计算,涉及分子式、结构式的确定、官能团性质、同分异构体书写等知识,题目难度中等,是对学生综合能力的考查,确定分子式是解题的关键,注意掌握常见有机物结构与性质.

| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度均降低 | |
| B. | SO2能使品红溶液和溴水均褪色 | |
| C. | 氯水和浓硝酸均要盛装在棕色试剂瓶中 | |
| D. | NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 食盐溶液能导电,所以它是电解质 | |
| C. | NaHSO4无论在水溶液里还是在熔融状态下都可以电离出Na+、H+和SO42- | |
| D. | SO3的水溶液可以导电,但它不是电解质 |
| A. | 1 mol Cl2与足量NaOH反应,转移的电子数为NA | |
| B. | 常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA | |
| C. | 1 mol碳烯(:CH2)所含的电子数目为6 NA | |
| D. | T℃时,1 L pH=6的纯水中含OH-数为10-6NA |
| A. | SO2+O2$?_{加热}^{催化剂}$ 2SO 3△H=-196.6 kJ/mol | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O( l )△H=-285.8 kJ/mol | |
| C. | 2H2( g )+O2( g )═2H2O ( l )△H=+571.6 kJ/mol | |
| D. | C(s)+O2( g )═CO2(g)△H=+393.5 kJ/mol |
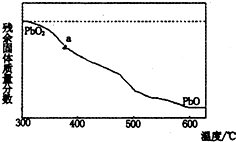 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3