题目内容
12.下列反应的离子方程式正确的是( )| A. | 铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸氢钠与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
分析 A.漏写氧化剂水;
B.漏写生成氢氧化镁的离子反应;
C.反应生成硫酸钠和水;
D.反应硝酸铜、NO、水.
解答 解:A.铝片跟氢氧化钠溶液反应的离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故A错误;
B.硫酸镁溶液跟氢氧化钡溶液反应的离子反应为2OH-+Cu2++SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故B错误;
C.硫酸氢钠与氢氧化钠溶液反应的离子反应为H++OH-═H2O,故C正确;
D.铜片跟稀硝酸反应的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
3.漂白粉的主要成分是( )
| A. | 次氯酸钙 | B. | 氯化钙 | ||
| C. | 次氯酸 | D. | 次氯酸钙与氯化钙 |
20.下列关于金属氧化物的说法中正确的是( )
| A. | Al2O3能与酸反应,但不能与碱反应 | |
| B. | FeO在空气中受热,会被氧化为Fe3O4 | |
| C. | Na2O2既有氧化性又有还原性,故Na2O2属于两性氧化物 | |
| D. | Na2O和Na2O2中阴、阳离子个数之比分别为1:2 和1:1 |
7.硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”.这主要是由于硅及其化合物对社会发展所起的巨大促进作用.下列关于硅及其化合物的说法中错误的是( )
| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |
4.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶的性质 |
18.硝酸钠为无色透明或淡黄色菱形晶体,主要用于制造硝酸钾、炸药、苦味酸和其他硝酸盐.其生产方法主要有硝酸尾气吸收法、离子交换法、中和法和复分解法.
(1)硝酸尾气吸收法是利用碱溶液吸收汽车尾气,该方法的优点是对尾气进行回收利用,减小污染.
(2)使用复分解法制备硝酸钠的流程如下:

①反应器和除钙器中发生反应的化学方程式分别为:Ca(NO3)2+Na2SO4=CaSO4↓+2NaNO3;Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3.
②酸化槽中,应加硝酸调节pH=7,才能使杂质除去,又减少硝酸的浪费;为提高酸化除杂的效率,除了适当提高硝酸浓度外,还可以采取的措施是可以搅拌、适当升高温度.
③研究生产过程中水、硫酸钠、碳酸钠的用量与硝酸钠浸出率之间的关系,其中水加入量对硝酸钠浸出率的影响的实验结果见下表:
从表中得出结论,在实际生产中水和硝酸钙的比为1:1时最佳,你觉得原因是:加水太少,硝酸钠浸出率低;加水太多,蒸发结晶时耗费太多能源,导致成本提高.
(3)用硝酸钠、木炭、硫磺也可以制得威力巨大的火药,爆炸时产生一种单质,一种氧化物以及一种金属硫化物,其中,除硝酸钠之外,另外一种氧化剂和还原剂的比为1:3,请写出该反应的方程式2NaNO3+S+3C=Na2S+N2↑+3CO2↑,.
(4)硝酸钠在加热条件下发生分解产生亚硝酸钠(NaNO2),某同学进行该实验得到粗产品,取2.000g产品配成l00.00mL溶液,取25.00mL溶液,用0.l000mol/L的酸性高锰酸钾溶液进行滴定,重复实验4次,平均消耗酸性高锰酸钾溶液的体积为19.50mL,则粗产品中亚硝酸钠的质量百分含量为为67.27%.
(摩尔质量:NaNO2-69g/mol)
(1)硝酸尾气吸收法是利用碱溶液吸收汽车尾气,该方法的优点是对尾气进行回收利用,减小污染.
(2)使用复分解法制备硝酸钠的流程如下:

①反应器和除钙器中发生反应的化学方程式分别为:Ca(NO3)2+Na2SO4=CaSO4↓+2NaNO3;Na2CO3+Ca(NO3)2=CaCO3↓+2NaNO3.
②酸化槽中,应加硝酸调节pH=7,才能使杂质除去,又减少硝酸的浪费;为提高酸化除杂的效率,除了适当提高硝酸浓度外,还可以采取的措施是可以搅拌、适当升高温度.
③研究生产过程中水、硫酸钠、碳酸钠的用量与硝酸钠浸出率之间的关系,其中水加入量对硝酸钠浸出率的影响的实验结果见下表:
| 水/硝酸钙 | 0.8:1 | 0.9:1 | 0.95:1 | 1:1 | 1.05:1 | 1.1:1 | 1.15:1 |
| 浸出率/% | 83.1 | 94.5 | 98.2 | 99.1 | 99.5 | 99.6 | 99.7 |
(3)用硝酸钠、木炭、硫磺也可以制得威力巨大的火药,爆炸时产生一种单质,一种氧化物以及一种金属硫化物,其中,除硝酸钠之外,另外一种氧化剂和还原剂的比为1:3,请写出该反应的方程式2NaNO3+S+3C=Na2S+N2↑+3CO2↑,.
(4)硝酸钠在加热条件下发生分解产生亚硝酸钠(NaNO2),某同学进行该实验得到粗产品,取2.000g产品配成l00.00mL溶液,取25.00mL溶液,用0.l000mol/L的酸性高锰酸钾溶液进行滴定,重复实验4次,平均消耗酸性高锰酸钾溶液的体积为19.50mL,则粗产品中亚硝酸钠的质量百分含量为为67.27%.
(摩尔质量:NaNO2-69g/mol)
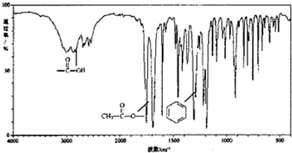 有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图:
有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图: .
.