题目内容
5.表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
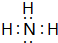 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
分析 由短周期元素的位置,可知A为H、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl、I为Mg.
(1)Si单质、碳的单质都可以形成原子晶体,但C-C键键长比Si-Si键键长短,C-C键更强;
(2)非金属性越强,对应氢化物越稳定;
(3)A与E可形成一种极易溶于水的气态化合物为NH3,其水溶液呈碱性;I与H形成的化合物为MgCl2,由镁离子与氯离子构成;
(4)A、F、C构成的化合物为NaOH,含有离子键、共价键,溶于水电离出钠离子与氢氧根离子.
解答 解:由短周期元素的位置,可知A为H、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl、I为Mg.
(1)Si单质、碳的单质都可以形成原子晶体,但C-C键键长比Si-Si键键长短,C-C键更强,故碳单质的熔点可能最高,故答案为:碳;
(2)C、Si同主族,自上而下非金属性增强,氢化物的稳定性增强,故氢化物稳定性CH4>SiH4,故答案为:碳的非金属性比硅的强;
(3)A与E可形成一种极易溶于水的气态化合物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为: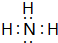 ,溶于水后溶液中一水合氨电离:NH3.H2O?NH4++OH-,溶于呈碱性;I与H形成的化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程为:
,溶于水后溶液中一水合氨电离:NH3.H2O?NH4++OH-,溶于呈碱性;I与H形成的化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程为: ,
,
故答案为: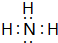 ;碱;
;碱; ;
;
(4)A、F、C构成的化合物为NaOH,含有离子键、极性共价键,溶于水电离出钠离子与氢氧根离子,离子键被破坏,故答案为:离子;极性共价;离子.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,注意用电子式表示化学键或物质的形成过程.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.由碳和氧两种元素组成的气体中,碳与氧的质量之比为3:5,则该气体可能是( )
| A. | 由CO或CO2单独组成的纯净物 | B. | 由CO和CO2共同组成的混合物 | ||
| C. | 由CO2和O2共同组成的混合物 | D. | 由CO、CO2和O2共同组成的混合物 |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105 Pa,32gO2所含原子数为NA | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,44gCO2含有的分子数为NA |
14.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程.其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应.其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑;
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH (未配平);
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH;
下列说法不正确的是( )
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑;
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH (未配平);
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH;
下列说法不正确的是( )
| A. | 碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 | |
| B. | 反应 ①、②、③均是氧化还原反应 | |
| C. | 反应 ②配平后,H2O的化学计量数是5 | |
| D. | 整个反应过程中每有16.8g Fe参加反应转移0.8mol电子 |






 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
. 和
和 .
.