题目内容
13.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+)<(填“=”>”“<”) NH4HSO4中c(NH4+)
(2)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A(填序号)
②室温时,0.1mol•L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1(填数值)
(3)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.
试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
分析 (1)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故答案为:<;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为A,故答案为:A;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1[c(OH-)太小,可忽略],故答案为:10-3;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查盐类的水解和离子浓度大小的比较,题目难度较大,(2)②为易错点,注意根据守恒思想解题.

| A. | 铜绿、氧化镁 | B. | 空气、石灰水 | C. | 矿泉水、水煤气 | D. | 海水、胆矾 |
| A. | CO | B. | CH4 | C. | N2 | D. | NO |
| A. | 羟基 | B. | 双键 | C. | 醛基 | D. | 酯基 |
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
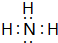 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
 (1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.
(1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.