题目内容
实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠,某学生设计了如下方案:
(1)操作①进行后,所得到的残留物的组成是 .
(2)操作②进行后,如何判断SO42-已经除尽?可否改用Ba(NO3)2,为什么?
(3)操作③的目的是
(4)操作④的目的是
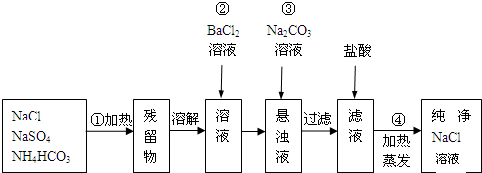
(1)操作①进行后,所得到的残留物的组成是
(2)操作②进行后,如何判断SO42-已经除尽?可否改用Ba(NO3)2,为什么?
(3)操作③的目的是
(4)操作④的目的是

考点:物质分离和提纯的方法和基本操作综合应用,物质分离、提纯的实验方案设计
专题:实验题
分析:由实验流程可知,只有碳酸氢铵加热分解生成氨气、水、二氧化碳,则①加热后的残留物为氯化钠、硫酸钠,溶解后②中加氯化钡与硫酸钠反应生成硫酸钡沉淀,再加③碳酸钠除去过量的氯化钡,过滤后滤液中加盐酸除去过量的碳酸钠,④加热蒸发使滤液中溶解的CO2和多余的HCl逸出,得到纯净的NaCl溶液,以此来解答.
解答:
解:由实验流程可知,只有碳酸氢铵加热分解生成氨气、水、二氧化碳,则①加热后的残留物为氯化钠、硫酸钠,溶解后②中加氯化钡与硫酸钠反应生成硫酸钡沉淀,再加③碳酸钠除去过量的氯化钡,过滤后滤液中加盐酸除去过量的碳酸钠,④加热蒸发使过量HCl逸出,得到纯净的NaCl溶液,
(1)由上述分析可知,①加热后的残留物为氯化钠、硫酸钠,故答案为:氯化钠、硫酸钠;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽;若加入硝酸钡溶液,和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠新的杂质,
答:浊液静置后取少量上层清液(或把浊液过滤,取少量滤液)滴加适量BaCl2溶液,若无白色沉淀生成,则溶液中的SO42-已经除尽;不能改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,以后操作中无法除去;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤,故答案为:除去过量的Ba2+;
(4)操作④加热煮沸溶液的目的是除去滤液中溶解的CO2和多余的盐酸,故答案为:除去滤液中溶解的CO2和多余的盐酸.
(1)由上述分析可知,①加热后的残留物为氯化钠、硫酸钠,故答案为:氯化钠、硫酸钠;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽;若加入硝酸钡溶液,和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠新的杂质,
答:浊液静置后取少量上层清液(或把浊液过滤,取少量滤液)滴加适量BaCl2溶液,若无白色沉淀生成,则溶液中的SO42-已经除尽;不能改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,以后操作中无法除去;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤,故答案为:除去过量的Ba2+;
(4)操作④加热煮沸溶液的目的是除去滤液中溶解的CO2和多余的盐酸,故答案为:除去滤液中溶解的CO2和多余的盐酸.
点评:本题考查混合物分离提纯的综合应用,为高频考点,把握实验流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.

练习册系列答案
相关题目
过氧化钠可与CO2反应,当16.4g Na2O2完全与CO2作用后,生成的Na2CO3的质量为( )
| A、21.2 g |
| B、21.6 g |
| C、22.0 g |
| D、22.3 g |
某主族元素最外层只有1个电子,则该元素一定是( )
| A、ⅠA族元素 |
| B、第ⅦA元素 |
| C、第三周期元素 |
| D、金属元素 |
等物质的量的下列烃,分别完全燃烧时,消耗O2最少的是( )
| A、C6H6 |
| B、CH4 |
| C、C2H4 |
| D、C7H8 |
检验淀粉已完全水解的试剂( )
| A、新制的Cu(OH)2悬浊液 |
| B、碘水 |
| C、NaOH溶液 |
| D、稀硫酸 |
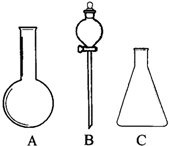 (1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管
(1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管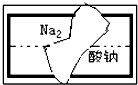 某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有白色固体的试剂瓶,标签破损(如图),请你根据已掌握的知识,对该药品可能是什么物质作出猜想(4种),并设计实验验证.
某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有白色固体的试剂瓶,标签破损(如图),请你根据已掌握的知识,对该药品可能是什么物质作出猜想(4种),并设计实验验证.