题目内容
1.由水电离产生的[H+]=10-13mol/L的溶液中,一定可以大量共存的离子组是( )| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Na+、K+、Cl- | D. | NO3-、K+、[Al(OH)4]-、OH- |
分析 由水电离产生的[H+]=10-13mol/L的溶液,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,则离子大量共存,以此来解答.
解答 解:A.酸溶液中不能大量存在CO32-,碱性溶液中不能大量存在NH4+,故A不选;
B.碱溶液中不能大量存在Mg2+、HCO3-,酸溶液中不能大量存在HCO3-,故B不选;
C.酸碱溶液中该组离子之间不反应,可大量共存,故C选;
D.酸溶液中不能大量存在[Al(OH)4]-、OH-,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,侧重于复分解反应类型的判断,注意常见离子的性质以及反应类型的判断,难度不大,注意相关基础知识的积累.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
11. 合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.
合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.
达到平稳时混合气体中氨的含量(体积百分比)(氮气和氢气的体积比是1:3)
如图是一透热性能很好的坚固容器,活塞C可左右移动.其总体积为44.8L,现将400℃、300大气压的氢气33.6L和400℃、300大气压的氮气11.2L充入容器中,当两者反应达到动态平稳时,若保持混合气体的温度和压强仍为400℃和300大气压,求:
(1)容器是向外界放热,还是吸热?为什么?
(2)试计算充入容器中氮气质量是多少克?
(3)活塞C要向左侧移动的距离与容器全长之比是多少?
 合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.
合成氨工业用氢和氮在催化剂作用下直接合成,如表表示在一定温度和压强作用下达到动态平稳时氨的含量.达到平稳时混合气体中氨的含量(体积百分比)(氮气和氢气的体积比是1:3)
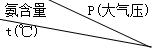 | 100 | 200 | 300 | 600 | 1000 |
| 200 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
(1)容器是向外界放热,还是吸热?为什么?
(2)试计算充入容器中氮气质量是多少克?
(3)活塞C要向左侧移动的距离与容器全长之比是多少?
12.下列叙述不正确的是( )
| A. | 工业上用电解法冶炼钠、镁、铝等活泼金属 | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,该电极反应式为Cu2++2e-=Cu | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.9kJ/mol可知,金刚石比石墨稳定 | |
| D. | 反应SO2(g)+2H2S(g)=3S (s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 |
9.在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
| A. | 常温下,将1 g铝片投入20 mL 18.4 mol•L-1的硫酸中 | |
| B. | 用50 mL浓盐酸与足量MnO2共热 | |
| C. | 向100 mL 3 moI•L-1的硝酸中加入5.6 g铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
16.A、B均为短周期金属元素.依据表数据,写出元素A的最高化合价+2,B元素原子的核外电子排布式1s22s22p63s2
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
6.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 浓硝酸和稀硝酸都具有强氧化性 | 浓硝酸和稀硝酸均可使紫色石蕊试液先变红后褪色 |
| B | 浓硫酸具有强氧化性和吸水性 | 浓硫酸可干燥H2和CO,不可干燥 SO2和NH3 |
| C | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
| D | 铵盐受热易分解 | NH4Cl和NH4HCO3均可用作氮肥和制取氨气 |
| A. | A | B. | B | C. | C | D. | D |
13.CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应的说法中正确的是( )


| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)所具有的总能量 | |
| C. | 反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=41 kJ•mol-1 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和H2O(g)要放出41 kJ的热量 |
11.下列过程发生化学变化的是( )
| A. | 蜡烛照明 | B. | 太阳能供热 | ||
| C. | 用金刚石切割玻璃 | D. | 酒香扑鼻 |
