题目内容
为使反应:Cu+2H2O=Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
| A、用铜片作阴、阳电极,电解稀硫酸 |
| B、用铜片作阴、阳电极,电解硫酸铜溶液 |
| C、用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D、用铜片、石墨、氯化钠溶液、导线等组成原电池 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该方程式中,铜不能自发进行反应,所以要设计成电解池,阳极上失电子发生氧化反应,阴极上得电子发生还原反应.
解答:
解:该方程式中,铜不能自发进行反应,所以要设计成电解池,铜失电子发生氧化反应,则铜作阳极,能导电的电极为阴极,位于氢之前的金属可溶性盐或酸作电解质,故选C.
点评:本题考查了原电池和电解池原理,根据电池反应式中得失电子的物质判断阴阳极及电解质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是( )| A、电池总反应为:4NH3+3O2=2N2+6H2O |
| B、电池工作时,OH-向正极移动 |
| C、电极2发生的电极反应为:O2+4H++4e-=2H2O |
| D、电流由电极1经外电路流向电极2 |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、0.1 mol Fe与足量的氯气反应时失去的电子数为0.2NA |
| B、标准状况下22.4L SO3含有的分子数为NA |
| C、6gSiO2晶体中含有的硅氧键数目为0.4NA |
| D、用Pt做电极电解硫酸铜溶液,当阳极产生的气体在标准状况下为22.4L时,转移电子数目为2NA |
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Cu2+、NH4+、Br-、OH- |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Ba2+、OH-、SO42- |
| D、H+、NO3-、Fe2+、Na+ |
电池在生产、生活中应用越来越广泛.下列说法错误的是( )
| A、化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电 |
| B、铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大 |
| C、燃料电池具有能量利用率高、可连续使用和污染轻等优点 |
| D、锂电池是一种高能电池,体积小、重量轻,单位质量能量比高 |
下列反应的离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| D、铜和浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
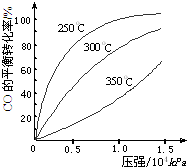 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.