题目内容
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.
制备纳米TiO2的方法之一是TiCl4水解生成TiO2?xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2?xH2O的化学方程式为 .
(2)检验TiO2?xH2O中Cl-是否被除净的方法是 .
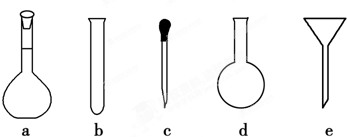
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是 ;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的 (填字母代号).
(4)滴定终点的现象是 .
制备纳米TiO2的方法之一是TiCl4水解生成TiO2?xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.

请回答下列问题:
(1)TiCl4水解生成TiO2?xH2O的化学方程式为
(2)检验TiO2?xH2O中Cl-是否被除净的方法是
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是
(4)滴定终点的现象是
考点:盐类水解的应用,溶液的配制,物质的分离、提纯和除杂,中和滴定
专题:盐类的水解专题,化学实验基本操作
分析:(1)根据反应物和生成物结合质量守恒定律来书写化学方程式;
(2)溶液中生成TiO2?xH2O沉淀,固体具有较强的吸附能力,会吸附溶液中的Cl-离子,可通过检验Cl-离子的方法检验沉淀是否被洗净;
(3)铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解,配制一定物质的量浓度的溶液所需要的仪器可根据具体的操作步骤选择;
(4)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3.
(2)溶液中生成TiO2?xH2O沉淀,固体具有较强的吸附能力,会吸附溶液中的Cl-离子,可通过检验Cl-离子的方法检验沉淀是否被洗净;
(3)铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解,配制一定物质的量浓度的溶液所需要的仪器可根据具体的操作步骤选择;
(4)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3.
解答:
解:(1)设TiCl4的系数为1,根据元素守恒,TiO2?xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),
故答案为:TiCl4+(x+2)H2O?TiO2?xH2O+4HCl;
(2)溶液中生成TiO2?xH2O沉淀,固体具有较强的吸附能力,会吸附溶液中的Cl-离子,可通过检验Cl-离子的方法检验沉淀是否被洗净,检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在,故答案为:取少量最后一次水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(3)铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解,配制一定物质的量浓度的溶液,配制溶液使用的仪器除天平、药匙、玻璃棒、烧杯、量筒、容量瓶和胶头滴管等,故答案为:抑制NH4Fe(SO4)2水解;a、c;
(4)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3,故答案为:溶液变为红色,且半分钟不褪色.
故答案为:TiCl4+(x+2)H2O?TiO2?xH2O+4HCl;
(2)溶液中生成TiO2?xH2O沉淀,固体具有较强的吸附能力,会吸附溶液中的Cl-离子,可通过检验Cl-离子的方法检验沉淀是否被洗净,检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在,故答案为:取少量最后一次水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(3)铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解,配制一定物质的量浓度的溶液,配制溶液使用的仪器除天平、药匙、玻璃棒、烧杯、量筒、容量瓶和胶头滴管等,故答案为:抑制NH4Fe(SO4)2水解;a、c;
(4)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3,故答案为:溶液变为红色,且半分钟不褪色.
点评:本题是围绕化学实验设计的综合性试题,主要考点有:化学方程式配平、沉淀的洗涤和溶液的配制、滴定操作等,难度中等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列溶液中含Cl-浓度最小的是( )
| A、10mL 0.1mol/L AlCl3的溶液 |
| B、20mL 0.2mol/LCaCl2的溶液 |
| C、30mL 0.2mol/LKCl的溶液 |
| D、100mL 0.25mol/LNaCl的溶液 |
25C 时,下列溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1 pH为4的NaHB溶液中,c(HB-)>c(H2B)>c(B2-) |
| B、0.4mol?L-1 NH4Cl和0.2mol?L-1 NaOH两种溶液等体积混合后pH=9:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| D、在0.1mol/L CH3COONa溶液中:c(H+)=c(CH3COOH)+c(OH-) |