题目内容
12.已知lg肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量.下列热化学方程式书写正确的是( )| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2Og)△H=-267.2 kJ•mol-l | |
| B. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-l | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(1)△H=-534.4 kJ•mol-l | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=534.4 kJ•mol-l |
分析 热化学方程式的书写:标明物质的聚集状态;焓变符号中的“+”和“-”代表吸热和放热,化学反应的焓变和物质的量相对应,1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则32g肼(N2H4)气体燃烧生成N2和H2O(g)时,放出534.4kJ的热量,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol,或$\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2Og)△H=-267.2 kJ•mol-l.
解答 解:A、1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则32g肼(N2H4)气体燃烧生成N2和H2O(g)时,放出534.4kJ的热量,16gN2H4,燃烧放热267.2 kJ,热化学方程式为:$\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2Og)△H=-267.2 kJ•mol-l,故A正确;
B、没注明物质的聚集状态,故B错误;
C、1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则32g肼(N2H4)气体燃烧生成N2和H2O(g)时,放出534.4kJ的热量,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol,故C错误;
D、反应为放热,焓变为负值,故D错误;
故选A.
点评 本题主要考查了热化学方程式的书写和注意问题,难度不大,根据课本知识即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列解释实验事实的方程式正确的是( )
| A. | 碳酸钠粉末滴少量水变成碳酸钠晶体:Na2CO3+xH2O═Na2CO3•xH2O | |
| B. | 饱和氯水中滴入NaHCO3溶液产生气泡:HClO+HCO3-═CO2↑+H2O+ClO- | |
| C. | 钠在空气中燃烧:4Na+O2═2Na2O | |
| D. | 大理石溶于盐酸:CO32-+2H+═CO2↑+H2O |
7.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L H2中所含质子数、中子数均为2NA | |
| B. | 46g NO2气体和46g N2O4气体的分子数之比为2:1 | |
| C. | 1L 1 mol•L-1的盐酸中所含粒子总数为2NA | |
| D. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA |
17.为除去铜粉中混有的少量铝粉,下列试剂不可行的是( )
| A. | CuCl2溶液 | B. | 稀硝酸 | C. | NaOH溶液 | D. | 稀盐酸 |
4.向500mL bmol/L稀硝酸中加入等物质的量的铁粉和铜粉的混合物18g,充分反应(设HNO3只被还原成NO).下列有关该反应的判断正确的是( )
| A. | 若铜有剩余,则向反应后的溶液中再滴加硫酸,铜也不能溶解 | |
| B. | 若金属全部溶解,则反应后的溶液中一定含有Cu2+、Fe3+离子 | |
| C. | 若铁粉全部转化为Fe2+离子,则b的值为0.8 | |
| D. | 若反应后的溶液中n(Fe3+):n(Fe2+)=3:2,则产生的NO为5152 mL(标准状况) |
5.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )
| A. | Na+、Fe3+、Cl-、ClO- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Na+、K+、Cl-、SO42- |
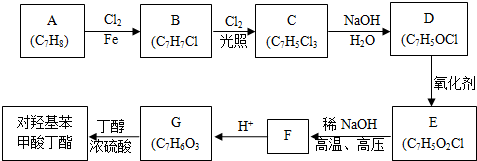 对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.:
对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.: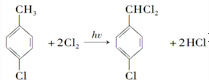 ,
, ;
;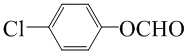 (写结构简式).
(写结构简式).