题目内容
1.(1)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(2)对AlCl3溶液加热蒸干灼烧最后变成Al2O3,Na2CO3溶液显碱性是因为CO32-的水解,配制FeCl3溶液应加入一定量的盐酸来抑制Fe3+的水解.
分析 (1)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(2)AlCl3溶液在加热蒸干时水解生成Al(OH)3,Al(OH)3在加热条件下分解生成Al2O3,Na2CO3溶液显碱性是因为碳酸根离子结合水电离出的氢离子促进水电离平衡正向进行,溶液显碱性,氯化铁溶液中铁离子水解生成氢氧化铁和盐酸,加入对应的酸抑制水解;
解答 解:(1)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl2•2H2O晶体在干燥的HCl气流中加热脱水,
故答案为:2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O,在干燥的HCl气流中加热脱水;
(2)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,Na2CO3溶液显碱性是因为碳酸根离子结合水电离出的氢离子促进水电离平衡正向进行,溶液显碱性,分解生成Al2O3.氯化铁为强酸弱碱盐,铁离子生成生成氢氧化铁和氯化氢,导致氯化铁溶液中氯化铁浓度减小,为防止氯化铁水解,配制溶液过程中要加入盐酸,
故答案为:Al2O3、CO32-、盐酸、Fe3+;
点评 本题考查了盐类水解,根据盐类水解特点结合“谁弱谁水解、谁强谁显性”来分析解答,注意:如果配制氯化铁溶液时,要考虑水解被抑制的试剂添加不能引入新的杂质,题目较简单.

 阅读快车系列答案
阅读快车系列答案| A. | 麦芽糖 | B. | 淀粉 | C. | 纤维素 | D. | 蛋白质 |
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2Og)△H=-267.2 kJ•mol-l | |
| B. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-l | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(1)△H=-534.4 kJ•mol-l | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=534.4 kJ•mol-l |
| A. | 热化学方程式中化学计量数表示分子个数 | |
| B. | Q=483.6 | |
| C. | Q>483.6 | |
| D. | Q<483.6 |
| A. | 氨基酸 | B. | 纤维素 | C. | 葡萄糖 | D. | 乙酸 |
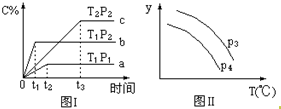 在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)?xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)?xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )| A. | P3<P4,y轴表示B的体积分数 | |
| B. | P3<P4,y轴表示混合气体的密度 | |
| C. | P3>P4,y轴表示B的百分含量 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
| A. | 0.05mol•L-1 | B. | 0.1mol•L-1 | C. | 0.15mol•L-1 | D. | 0.2mol•L-1 |
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 冰醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
| C | 碱石灰 | 王水 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | A | B. | B | C. | C | D. | D |