题目内容
下列有关说法正确的是( )
| A、常温下,0.1mol?L-1 CH3COOH溶液的pH=1 |
| B、铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C、反应CO2(g)+C(s)═2CO(g)在低温下不能自发进行,则其△H>0 |
| D、常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
考点:弱电解质在水溶液中的电离平衡,反应热和焓变,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:A.醋酸是弱电解质,在水溶液里部分电离;
B.铅蓄电池放电过程中,负极电极反应式为Pb-2e-+SO42-=PbSO4↓、正极反应式为PbO2+2e-+4H++SO42-=PbSO4↓+2H2O;
C.如果△G=△H-T△S>0时该反应不能自发进行,否则能自发进行;
D.溶度积常数只与温度有关,与物质浓度无关.
B.铅蓄电池放电过程中,负极电极反应式为Pb-2e-+SO42-=PbSO4↓、正极反应式为PbO2+2e-+4H++SO42-=PbSO4↓+2H2O;
C.如果△G=△H-T△S>0时该反应不能自发进行,否则能自发进行;
D.溶度积常数只与温度有关,与物质浓度无关.
解答:
解:A.醋酸是弱电解质,在水溶液里部分电离,所以常温下,0.1mol?L-1 CH3COOH溶液中的c(H+)<0.1mol/L,所以pH>1,故A错误;
B.铅蓄电池放电过程中,负极电极反应式为Pb-2e-+SO42-=PbSO4↓、正极反应式为PbO2+2e-+4H++SO42-=PbSO4↓+2H2O,所以负极质量增加,正极pH增大,故B错误;
C.如果△G=△H-T△S>0时该反应不能自发进行,该反应的熵变△S>0,且该反应不能自发进行,所以其△H>0,故C正确;
D.溶度积常数只与温度有关,与物质浓度无关,所以温度不变,则Ksp(AgCl)不变,故D错误;
故选C.
B.铅蓄电池放电过程中,负极电极反应式为Pb-2e-+SO42-=PbSO4↓、正极反应式为PbO2+2e-+4H++SO42-=PbSO4↓+2H2O,所以负极质量增加,正极pH增大,故B错误;
C.如果△G=△H-T△S>0时该反应不能自发进行,该反应的熵变△S>0,且该反应不能自发进行,所以其△H>0,故C正确;
D.溶度积常数只与温度有关,与物质浓度无关,所以温度不变,则Ksp(AgCl)不变,故D错误;
故选C.
点评:本题考查较综合,涉及弱电解质电离、溶度积常数、原电池原理等知识点,明确弱电解质电离特点、电极反应式的书写、溶度积常数的影响因素即可解答,注意溶度积常数只与温度有关,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子反应方程式正确的是( )
| A、氯化铝溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O |
| B、碳酸钙与盐酸反应:CaCO3+2H+→Ca2++CO2↑+H2O |
| C、锌粉溶解于醋酸:Zn+2H+→Zn2++H2↑ |
| D、硫酸镁溶液跟氢氧化钡溶液反应:Mg2++SO42-+Ba2++2OH-→BaSO4↓+Mg(OH)2↓ |
杀虫剂“阿乐丹”的结构表示为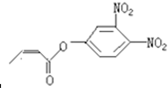 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )| A、遇FeCl3溶液均显紫色 |
| B、均能发生银镜反应 |
| C、均能与溴水发生反应 |
| D、均能与NaOH溶液发生反应下列 |