题目内容
在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A、2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | ||
| B、S(s)+O2(g)=SO2(g);△H1 S(g)+O2(g)=SO2(g);△H2 | ||
C、CO(g)+
| ||
| D、NaOH(aq)+HCl (aq)=NaCl(aq)+H2O;△H1 NaOH(aq)+CH3COOH (aq)=CH3COONa (aq)+H2O;△H2 |
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、化学反应方程式的系数加倍,焓变数值加倍;
D、醋酸是弱电解质,电离吸热.
B、固体硫变为气态硫需要吸收热量;
C、化学反应方程式的系数加倍,焓变数值加倍;
D、醋酸是弱电解质,电离吸热.
解答:
解:A、物质的燃烧反应是放热的,焓变是负值,液态水变为气态水的过程是吸热的,则生成液态水放热多,故△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,气态硫放出的热量多,所以△H1>△H2,故B错误;
C、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,故△H1>△H2,故C错误;
D、醋酸是弱电解质,电离吸热,所以醋酸与氢氧化钠反应放出的热量少,则△H2>△H1,故D正确;
故选:D.
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,气态硫放出的热量多,所以△H1>△H2,故B错误;
C、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,故△H1>△H2,故C错误;
D、醋酸是弱电解质,电离吸热,所以醋酸与氢氧化钠反应放出的热量少,则△H2>△H1,故D正确;
故选:D.
点评:本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
相关题目
下列装置图及有关说法正确的是( )
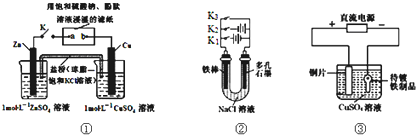

| A、装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 |
| B、装置①中K键闭合时,片刻后可观察到滤纸a点变红色 |
| C、装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 |
| D、装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA |
将0.1mol?L-1HCN溶液与等体积等浓度的NaCN溶液混合,溶液显碱性,下列关系不正确的是( )
| A、c(Na+)>c(CN-)>c(OH-)>c(H+) |
| B、c(CN-)<c(HCN) |
| C、c(CN-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(CN-)+c(OH-) |
同质量的下列烃,分别在氧气中充分燃烧,消耗氧气最多的是( )
| A、甲烷 | B、乙炔 | C、丙烯 | D、甲苯 |
用Pt电极电解AgF(aq),电流强度为a A,通电时间为t min,阴极增重m g,阳极上生成标准状况下的纯净气体V L,以q C表示一个电子的电量,Mr示Ag的相对原子质量,则阿伏加德罗常数NA可表示为( )
A、
| ||
B、
| ||
C、
| ||
| D、以上答案都不对 |
维生素C可用于防治坏血病,其结构如图所示.下列关于维生素C的叙述错误的是( )
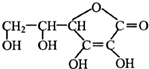

| A、维生素C可作食品添加剂 |
| B、维生素C具有抗氧化作用 |
| C、维生素C的分子式为C6H8O6 |
| D、维生素C加入紫色石蕊试液,溶液变红色,说明维生素C的水溶液显碱性 |
下列关于溶液和胶体的叙述中不正确的是( )
| A、一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| B、在胶体中加入少量电解质溶液时,可能使胶体发生聚沉 |
| C、溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D、溶液中溶质粒子直径小于1nm,而胶体粒子直径在1nm~100nm之间 |
下列化学反应达到平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
| A、SO2(g)+NO2(g)?SO3(g)+NO(g) (正反应为放热反应) |
| B、C(s)+CO2(g)?2CO(g) (正反应为吸热反应) |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
| D、H2S(g)?H2(g)+S(s) (正反应为吸热反应) |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、利用1mol/L FeCl3溶液制得氢氧化铁胶体的胶粒数目一定小于1NA |
| B、10L 18.4mol?L-1硫酸与64g铜加热反应,生成SO2分子的数目一定小于1NA |
| C、通常状况下,22.4L氯气与烧碱溶液完全反应,转移电子数目一定小于1NA |
| D、标准状况下,22.4LHF所含分子数为1NA |