题目内容
3.下列说法不正确的是( )| A. | 晶体硅是一种半导体材料,常用于制造光导纤维 | |
| B. | 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| C. | 铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作 | |
| D. | 金属钠可用于冶炼钛等金属 |
分析 A.硅不具有光的全反射性;
B.碳酸氢钠分解以及与酸反应都生成二氧化碳;
C.氯化铁具有强氧化性;
D.钠性质活泼,可置换出钛等金属.
解答 解:A.硅具有导电性,可用于半导体材料,但不具有光的全反射性,制造光导纤维的主要原料为二氧化硅,故A错误;
B.碳酸氢钠和酸反应生成二氧化碳,所以发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔,故B正确;
C.氯化铁具有强氧化性,可与铜反应生成氯化亚铁和氯化铜,可以应用于印刷电路板的制作,故C正确;
D.钠性质活泼,可置换出钛等金属,故D正确.
故选A.
点评 本题考查元素化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
11.下列不能用来鉴别浓硫酸和稀硫酸的是( )
| A. | Fe | B. | 胆矾 | C. | 含酚酞的碱溶液 | D. | pH试纸 |
18.下列离子方程式不正确的是( )
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| B. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | FeCl2溶液和Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
8.下列离子方程式正确的是( )
| A. | Cl2 和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 硫酸铜溶液与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化亚铁溶液中通足量Cl2: Cl2+Fe2+═Fe3++2Cl- | |
| D. | 碳酸氢钙溶液和少量的澄淸石灰水混合:HCO3-+Ca2++OH-═CaCO3↓+H2O |
1.某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol•L-1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
(1)溶液中含有Na2CO3的质量为1.06g;
(2)Na2CO3和NaHCO3的混合溶液中c(HCO3-)为1.00mol•L-1.
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
(2)Na2CO3和NaHCO3的混合溶液中c(HCO3-)为1.00mol•L-1.

 以上R、R′、R″代表烃、烷基或芳基等)
以上R、R′、R″代表烃、烷基或芳基等)
 ,则与F具有相同官能团的同分异构体共5种(考虑顺反异构,不包含F).
,则与F具有相同官能团的同分异构体共5种(考虑顺反异构,不包含F). ,反应类型为消去反应.
,反应类型为消去反应.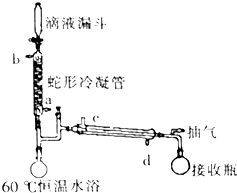 过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下:
过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下: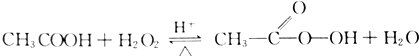 ,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.