题目内容
20. 下面是硫及其化合物的分类图,请回答下列问题:
下面是硫及其化合物的分类图,请回答下列问题:(1)图中Ⅰ、Ⅱ分别代表的是化合价为+4、化合物为酸.
(2)写出满足下列要求的常见盐的化学式:CuSO4.
①水溶液呈蓝色 ②化合物中硫元素为+6价
(3)用如图所列物质完成下列方程式(反应需要的H2O可任意选用):
①生成SO2的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
②生成NaHSO3的离子方程式:Na2SO3+SO2+H2O=2NaHSO3.
分析 (1)图中Ⅰ为硫元素的化合价为+4价,Ⅱ为硫元素形成的化合物为酸;
(2)物质属于盐,满足①水溶液呈蓝色 ②化合物中硫元素为+6价,说明是硫酸铜溶液;
(3)①生成SO2的反应是硫单质燃烧生成二氧化硫,亚硫酸钠和浓硫酸反应生成二氧化硫;
②生成NaHSO3的反应是二氧化硫和亚硫酸钠、水反应生成碳酸氢钠;
解答 解:(1)依据图中表示的关系分析可知,图中Ⅰ为硫元素的化合价为+4价,Ⅱ为硫元素形成的化合物为酸,
故答案为:化合价为+4,化合物为酸;
(2)物质属于盐,满足①水溶液呈蓝色 ②化合物中硫元素为+6价,说明是硫酸铜溶液,化学式为:CuSO4,
故答案为:CuSO4;
(3)①生成SO2的反应是硫单质燃烧生成二氧化硫,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,亚硫酸钠和浓硫酸反应生成二氧化硫,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②生成NaHSO3的反应是二氧化硫和亚硫酸钠、水反应生成碳酸氢钠,反应的化学方程式为:Na2SO3+SO2+H2O=2NaHSO3,
故答案为:Na2SO3+SO2+H2O=2NaHSO3;
点评 本题考查了硫及其化合物组成、性质、转化的分析应用,注意硫元素依据化合价和依据存在性质的分类方法,题目较简单.

练习册系列答案
相关题目
10.下列物质中,属于电解质的是( )
| A. | NaOH | B. | CH3CH2OH(酒精) | C. | 蔗糖 | D. | CO2 |
11.请根据下列信息判断氢气燃烧生成水蒸气时的量变化.下列有关叙述正确的是( )
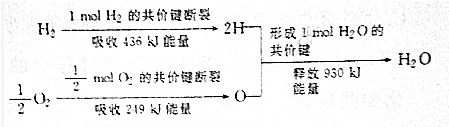

| A. | 氢气燃烧生成水蒸气时吸收热量 | |
| B. | 生成1molH2O吸收热量245kJ | |
| C. | 2molH和1molO所具有的能量大于1molH2和$\frac{1}{2}$molO2所具有的总能量 | |
| D. | 氢气和氧气的总能量大于水的能量 |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 室温下,向1L 0.10mol•L-1 CH3COOH溶液中通人HCl至溶液pH=7时溶液中氯离子与醋酸根离子的微粒数目之和为0.2NA | |
| B. | 25℃时,1L pH=12的NaOH溶液中,由水电离的H+数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | H2SO4(浓)+H2S=SO2↑+S↓+2H2O反应中,生成64gSO2时,转移的电子数目为6NA. |
15.在15毫升苯中溶解26g乙炔,所得混和液中碳元素的质量百分含量为( )
| A. | 40% | B. | 66.7% | C. | 75% | D. | 92.3% |
3.我国科学家屠呦呦因发现青蒿素(化学式是C15H22O5),而获得2015年诺贝尔奖.青蒿素属于( )
| A. | 碱 | B. | 盐 | C. | 氧化物 | D. | 有机物 |
10.化学与生产、生活、环境密切相关.下列说法正确的是( )
| A. | 日常生中无水乙醇常用于杀菌消毒 | |
| B. | 目前加碘盐中主要添加的是KI | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
7.已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-QkJ•mol-1(Q>0).下列说法正确的是( )
| A. | 相同条件下,SO2(g)和O2(g)所具有的能量大于SO3所具有的能量 | |
| B. | 将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |