题目内容
1.用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:(1)准确称量4.1g含有少量中性易溶杂质的样品,配成250mL待测溶液.称量时样品可放在A(填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,不可选用B(填编号字母)作指示剂.
(A)甲基橙 (B)石蕊 (C)酚酞
(3)用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化和滴液的流速,直到滴定终点.
(4)根据你所选择的指示剂,正确判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色.
(5)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4020mol•L-1,烧碱样品的纯度是98.05%
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 0.20 | 20.80 |
| 第三次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
分析 (1)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
(3)滴定时用左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点;
(4)中和滴定的滴定终点判断方法;
(5)根据C(待测)═C(标准)×V(标准)÷V(待测)计算,V(标准)用两次的平均值;
根据m=CVM计算500mL溶液中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数;
(6)根据C(待测)═C(标准)×V(标准)÷V(待测)分析误差.
解答 解:(1)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量,防止玷污托盘.因烧碱易潮解,所以应放在小烧杯中称量,故选A;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂,故选B;
(3)滴定时用左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化和滴液的流速,直到滴定终点,故答案为:左;右;锥形瓶内溶液颜色变化和滴液的流速;
(4)判断滴定终点的方法:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色,
故答案为:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色;
(5)由于第2次实验的数据偏大,故舍去.V(标准)=[(20.50-0.40)+(24.00-4.10)]mL÷2=20.00mL,
C(待测)═$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.2010mol/L×0.02L}{0.01L}$═0.4020mol•L-1,
m(烧碱)═CVM═0.4020mol•L-1×0.25L×40g/mol═4.02g
ω═$\frac{4.02g}{4.1g}$×100%═98.05%,
故答案为:0.4020;98.05%;
(6)①开始仰视,滴定终点平视,导致计算出的标准液体积偏小,浓度偏低,故答案为:偏低;
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,导致待测液的物质的量增加,消耗的标准液体积增大,结果偏高,故答案为:偏高.
点评 本题考查了滴定操作.操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响,本题难度中等.

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案( )
| A. | 反应中化合价升高的元素是NH3中的H | |
| B. | 该反应利用了Cl2的强还原性 | |
| C. | NH3在反应中得到电子 | |
| D. | 生成1molN2有6mol电子转移 |
| A. | SO${\;}_{4}^{2-}$的摩尔质量是96g/mol | |
| B. | 1molH2中含有2molH | |
| C. | 1molH2O的质量等于NA个H2O质量的总和 | |
| D. | 1molO2的质量为32g/mol |
| A. | 11.2L | B. | 22.4L | C. | 33.6L | D. | 44.8L |
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-246.4 kJ•mol-1.
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是bce.
a.高温低压 b.低温高压
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(5)将CH4设计成燃料电池,其装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-;
③V=67.2L时,溶液中阴离子浓度大小关系为c(HCO3-)>c(CO32-)>c(OH-).
 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( ) +2C2H5OH
+2C2H5OH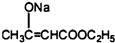 +CH3COOH→
+CH3COOH→ +CH3COONa
+CH3COONa
