题目内容
16.下列说法不正确的是( )| A. | SO${\;}_{4}^{2-}$的摩尔质量是96g/mol | |
| B. | 1molH2中含有2molH | |
| C. | 1molH2O的质量等于NA个H2O质量的总和 | |
| D. | 1molO2的质量为32g/mol |
分析 A.摩尔质量以g/mol为单位,数值上等于其相等分子质量;
B.氢原子物质的量为氢气分子的2倍;
C.1molH2O含有NA个H2O分子;
D.1molO2的质量为32g.
解答 解:A.SO42-的相对分子质量为96,故其摩尔质量为96g/mol,故A正确;
B.每个氢气分子含有2个H原子,氢原子物质的量为氢气分子的2倍,则1molH2中含有2molH,故B正确;
C.1molH2O含有NA个H2O分子,则1molH2O的质量等于NA个H2O质量的总和,故C正确;
D.O2的摩尔质量为32g/mol,1molO2的质量为32g,故D错误,
故选D.
点评 本题考查摩尔质量、物质的量计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
6.对达到平衡状态的下列各可逆反应,加压和降温都能使平衡逆向移动的是( )
| A. | 2NO2(g)═2NO(g)+O2(g)△H>0 | B. | 2 CO(g)═C(s)+CO2(g)△H>0 | ||
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | 2O3(g)═3O2(g)△H<0 |
4.常温下,有关物质的溶度积如表所示.
下列有关说法不正确的是( )
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
| A. | 常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 | |
| B. | 常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 | |
| C. | 向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021 | |
| D. | 无法利用Ca(OH)2制备NaOH |
11.下列化学用语正确的是( )
| A. | 硝基苯的结构简式: | B. | 乙烯的比例模型: | ||
| C. | 过氧化氢的电子式: | D. | 硫离子的结构示意图: |
1.开发新材料是现代科技发展的方向,下列有关材料的说法不正确的是( )
| A. | 高温结构陶瓷是新型无机非金属材料 | |
| B. | 钢是用量最大、用途最广的合金,分为碳素钢和合金钢 | |
| C. | 硅芯片是各种计算机、微电子产品的核心材料 | |
| D. | 单晶硅常用于制造光导纤维 |
1.用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量4.1g含有少量中性易溶杂质的样品,配成250mL待测溶液.称量时样品可放在A(填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,不可选用B(填编号字母)作指示剂.
(A)甲基橙 (B)石蕊 (C)酚酞
(3)用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化和滴液的流速,直到滴定终点.
(4)根据你所选择的指示剂,正确判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色.
(5)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4020mol•L-1,烧碱样品的纯度是98.05%
(6)下列实验操作会对滴定结果产生的后果.(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
(1)准确称量4.1g含有少量中性易溶杂质的样品,配成250mL待测溶液.称量时样品可放在A(填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,不可选用B(填编号字母)作指示剂.
(A)甲基橙 (B)石蕊 (C)酚酞
(3)用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化和滴液的流速,直到滴定终点.
(4)根据你所选择的指示剂,正确判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色.
(5)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4020mol•L-1,烧碱样品的纯度是98.05%
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 0.20 | 20.80 |
| 第三次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
18.铜和其化合物是中学化学的重要学习内容.
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.
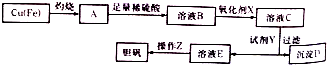
已知:
请回答:
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.

已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].