题目内容
8.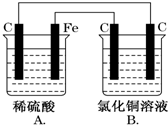 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )| A. | A为原电池,B为电解池 | |
| B. | A中阳离子向碳极移动,阴离子向铁极移动 | |
| C. | 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol | |
| D. | 一段时间后,B烧杯中溶液的浓度增大 |
分析 A.A中Fe、C、稀硫酸构成原电池,则B为电解池;
B.原电池工作时,阳离子移向正极,阴离子移向负极;
C.A中C上的电极反应式为:2H++2e-=H2↑,B中阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2↑,根据转移电子守恒分析;
D.B中电解氯化铜,溶液的浓度减小.
解答 解:A.A中Fe、C、稀硫酸构成原电池,A、B相连,B有外接电源,所以B为电解池,故A正确;
B.A中Fe、C、稀硫酸构成原电池,活泼金属铁作负极,碳作正极,原电池工作时,阳离子移向正极(碳),阴离子称向负极(铁),故B正确;
C.A中C上有氢气生成,其电极反应式为:2H++2e-=H2↑,当A烧杯中产生0.1mol气体时,转移0.2mol电子,B中阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2↑,当转移0.2mol电子时,生成氯气为0.1mol,所以A和B中生成气体的物质的量相同,故C正确;
D.B中为惰性电极电解电解氯化铜,所以一段时间后,B烧杯中溶液的浓度会减小,故D错误.
故选D.
点评 本题考查了原电池原理和电解池原理的应用,注意根据电池中转移的电子守恒来计算生成的气体的物质的量,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
18.下列表示化学过程的化学式书写正确的是( )
| A. | 亚硫酸钠溶液显碱性:SO32-+2 H2O?H2SO3+2 OH- | |
| B. | 氯化银投入水中后建立平衡:AgCl (s)?Ag+(aq)+Cl-(aq) | |
| C. | 甲烷的燃烧热为890.3kJ•mol-1,表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |
3.往AgNO3 和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中的溶质是( )
| A. | AgNO3 和Cu(NO3)2 | B. | Cu(NO3)2和Fe(NO3)2 | C. | AgNO3 和Fe(NO3)2 | D. | Fe(NO3)2 |
13.实验室中的药品常按物质的性质、类别等有规律地摆放.现有部分药品按某种规律的摆放在实验桌上,如下图.做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是( )
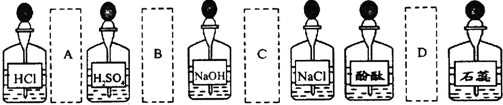

| A. | A | B. | B | C. | C | D. | D |
17.制备硅单质时,主要化学反应如下:
(1)SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(2)Si+2Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
(1)SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(2)Si+2Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
| A. | (1)(3)为置换反应 | B. | (2)为化合反应 | ||
| C. | 只有(1)(3)为氧化还原反应 | D. | (1)(2)(3)均为氧化还原反应 |