题目内容
3.往AgNO3 和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中的溶质是( )| A. | AgNO3 和Cu(NO3)2 | B. | Cu(NO3)2和Fe(NO3)2 | C. | AgNO3 和Fe(NO3)2 | D. | Fe(NO3)2 |
分析 充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,说明析出的金属中存在铁,以此解答该题.
解答 解:在金属活动性顺序中,铁>氢>铜>银,往滤渣中加入稀盐酸,有无色气体放出,则说明滤渣中含有铁,铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,当有铁剩余时,说明硝酸铜和硝酸银全部参加反应,滤液中无硝酸铜和硝酸银,只有生成的硝酸亚铁,
故选D.
点评 本题考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意把握常见金属的活动性,把握物质的性质以及题给信息,难度大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
13.与饱和链烃、不饱和链烃相比较,苯的独特性质具体来说是( )
| A. | 难氧化,易加成,难取代 | |
| B. | 能氧化,难加成,易取代 | |
| C. | 易氧化,易加成,难取代 | |
| D. | 因是单双键交替结构,故易加成为环己烷 |
14.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )


| A. | 氢化物的沸点R>X | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:X>Y | |
| D. | X、Z形成的化合物中可能含有共价键 |
18.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一 配制并标定醋酸溶液的浓度:取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2 0mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250 mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.200 0mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol/L(保留小数点后四位).
实验二 探究浓度对醋酸电离程度的影响:用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”、“减小”或“不变”).
实验三 探究温度对醋酸电离程度的影响:
(5)请你设计一个实验完成该探究,请简述你的实验方案(文字加表格).
实验一 配制并标定醋酸溶液的浓度:取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2 0mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250 mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.200 0mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积/mL | 20.05 | 20.00 | 18.80 | 19.95 |
实验二 探究浓度对醋酸电离程度的影响:用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L-1 ) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”、“减小”或“不变”).
实验三 探究温度对醋酸电离程度的影响:
(5)请你设计一个实验完成该探究,请简述你的实验方案(文字加表格).
8.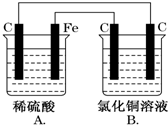 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )| A. | A为原电池,B为电解池 | |
| B. | A中阳离子向碳极移动,阴离子向铁极移动 | |
| C. | 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol | |
| D. | 一段时间后,B烧杯中溶液的浓度增大 |
15.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2H2O(l)═2H2(g)+O2(g)△H=+571.6KJ•mol-1,无法求H2的燃烧热 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性 | |
| C. | 已知500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出19.3KJ的热量,无法推出该反应的热化学方程式 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,无法得出△H2>△H1 |
12.下列说法中不正确的为( )
| A. | 面对日益严重的环境问题,化学显得无能为力 | |
| B. | 化学的探索空间广阔,可以在能源、资源的合理开发和安全利用方面大显身手 | |
| C. | 化学可以帮助人们攻克一个个医学难题 | |
| D. | 化学是一门具有实用性的科学 |
13. 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | 这种硫酸在常温下不能使铁钝化 | |
| D. | 配制80mL2.3mol•L-1的稀硫酸需量取该硫酸10mL |