题目内容
关于反应11P+15CuSO4+24H2O→5Cu3P+6H3PO4+15H2SO4,下列说法正确的是( )
| A、P仅作还原剂,其氧化产物是H3PO4 |
| B、每转移3mol电子,有0.6mol P被氧化 |
| C、15molCuSO4可氧化6molP |
| D、该反应的氧化剂与还原剂的物质的量之比为5:6 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,P元素的化合价由0降低为-3价,这样的P原子是5mol,还有P元素的化合价由0升高为+5价,这样的P原子是6mol,Cu元素的化合价由+2价降低为+1价,根据氧化还原反应中的概念以此电子守恒知识来解答.
解答:
解:A、在反应中,P既被氧化又被还原,所以既是氧化剂又是还原剂,故A错误;
B、反应中转移电子30mol,被氧化的磷是6mol,所以每转移3mol电子,有0.6molP被氧化,故B正确;
C、根据反应知道,是15molCuSO4和5molP来一起氧化6molP,故C错误;
D、该反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中部分磷作氧化剂,部分磷作还原剂,硫酸铜是氧化剂,5P(氧化剂)+6P(还原剂)+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,所以氧化剂和还原剂的物质的量之比=(15+5):6=10:3,故D错误.
故选B.
B、反应中转移电子30mol,被氧化的磷是6mol,所以每转移3mol电子,有0.6molP被氧化,故B正确;
C、根据反应知道,是15molCuSO4和5molP来一起氧化6molP,故C错误;
D、该反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中部分磷作氧化剂,部分磷作还原剂,硫酸铜是氧化剂,5P(氧化剂)+6P(还原剂)+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,所以氧化剂和还原剂的物质的量之比=(15+5):6=10:3,故D错误.
故选B.
点评:本题考查了氧化剂和还原剂的判断、电子转移等知识点,注意该反应中P既是氧化剂又是还原剂,会根据元素化合价的变化判断氧化剂、还原剂和氧化产物、还原产物,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某元素的核外有三个电子层,其最外层电子数是次外层电子数的一半,这元素位于周期( )
| A、第4周期ⅢA族 |
| B、第4周期ⅦA族 |
| C、第3周期ⅣB族 |
| D、第3周期ⅣA族 |
下列各组物质中,互为同素异形体的是( )
| A、13C 和14C |
| B、红磷和白磷 |
| C、氯水和液氯 |
| D、重水和超重水 |
下列图示的装置可以构成原电池的是( )
A、 硝酸银溶液 |
B、 稀H2SO4 |
C、 NaOH溶液 |
D、 乙醇 |
科学家发现了如下反应:O2+PtF6=O2 (PtF6),其中O2(PtF6)为离子化合物,其中Pt为+5价.下列说法正确的是( )
| A、O2 (PtF6) 中不存在共价键 |
| B、O2 (PtF6)中氧元素的化合价是+l价 |
| C、在此反应中,O2是氧化剂,PtF6是还原剂 |
| D、在此反应中每生成1mol O2 (Pt F6),转移6.02×1023个电子 |
下列离子方程式正确的是( )
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氧化钠与盐酸反应:O2-+2H+=H2O |
| C、CaCO3悬浊液中通CO2:CO32-+CO2+H2O=2HCO3- |
| D、小苏打溶液与NaOH溶液混合:HCO3-+OH-=CO32-+H2O |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
| B、1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C、100mL 0.2mol?L-1的AlCl3溶液中,含Al3+数为0.02NA |
| D、标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA |
 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知:
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知: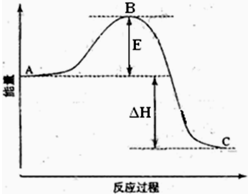 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: