题目内容
10.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 向工业生产的反应中加入合适的催化剂,能改变反应的焓变 |
分析 A、3Cl2+8NH3═N2+6NH4Cl,该反应中产生白烟;
B、利用CO2合成聚碳酸酯类可降解塑料,减少二氧化碳的排放;
C、矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放;
D、催化剂改变速率,不改变平衡,不会引起化学反应的焓变的变化.
解答 解:A、3Cl2+8NH3═N2+6NH4Cl,利用该反应中产生白烟现象来检验氯气管道是否漏气,故A正确;
B、利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用应用,减少二氧化碳的排放,符合题意,故B正确;
C、SO2、NOx是污染性气体,大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NOx的排放,故C正确;
D、反应焓变只和反应物生成物有关,和反应过程无关,催化剂改变速率,不改变平衡,不会引起化学反应的焓变的变化,故D错误.
故选D.
点评 本题考查了化学与生活、社会密切相关知识,主要考查物质的性质以及应用,掌握常识、理解原因是关键,题目难度不大.

练习册系列答案
相关题目
20.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 1mol铁与足量的盐酸反应转移电子数为2 NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
18.下列离子方程式错误的是( )
| A. | 二氧化硅与苛性钠反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 在NaCl溶液中滴入AgNO3试液:Ag++Cl-═AgCl↓ | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
15.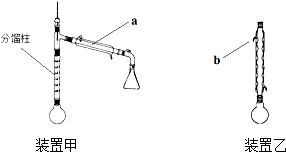 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
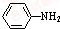 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O
有关化合物的物理性质见下表:
合成:
方案甲:采用装置甲(分馏柱的作用类似于石油分馏中的分馏塔).在圆底烧瓶中加入5.0mL 苯胺、7.4mL乙酸,加热至沸,控制温度计读数100~105℃,保持液体平缓流出,反应40min后停止加热.将圆底烧瓶中的液体趁热倒入盛有100mL水的烧杯,冷却后有乙酰苯胺固体析出,过滤得粗产物.
方案乙:采用装置乙,加热回流,反应40min后停止加热.其余与方案甲相同.
提纯:
甲乙两方案均采用重结晶方法.操作如下:
①加热溶解→②活性炭脱色→③趁热过滤→④冷却结晶→⑤过滤→⑥洗涤→⑦干燥
请回答:
(1)仪器a的名称是冷凝管,b处水流方向是出水(填“进水”或“出水”).
(2)合成步骤中,乙酰苯胺固体析出后,过滤分离出粗产物.留在滤液中的主要物质是乙酸.
(3)提纯过程中的第③步,过滤要趁热的理由是防止温度降低导致乙酰苯胺析出,降低产率.
(4)提纯过程第⑥步洗涤,下列洗涤剂中最合适的是A.
A.蒸馏水 B.乙醇 C.5%Na2CO3溶液 D.饱和NaCl溶液
(5)从投料量分析,为提高乙酰苯胺产率,甲乙两种方案均采取的措施是乙酸过量;实验结果表明方案甲的产率较高,原因是方案甲将反应过程中生成的水蒸出,促进反应.
 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: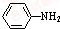 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O有关化合物的物理性质见下表:
| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
方案甲:采用装置甲(分馏柱的作用类似于石油分馏中的分馏塔).在圆底烧瓶中加入5.0mL 苯胺、7.4mL乙酸,加热至沸,控制温度计读数100~105℃,保持液体平缓流出,反应40min后停止加热.将圆底烧瓶中的液体趁热倒入盛有100mL水的烧杯,冷却后有乙酰苯胺固体析出,过滤得粗产物.
方案乙:采用装置乙,加热回流,反应40min后停止加热.其余与方案甲相同.
提纯:
甲乙两方案均采用重结晶方法.操作如下:
①加热溶解→②活性炭脱色→③趁热过滤→④冷却结晶→⑤过滤→⑥洗涤→⑦干燥
请回答:
(1)仪器a的名称是冷凝管,b处水流方向是出水(填“进水”或“出水”).
(2)合成步骤中,乙酰苯胺固体析出后,过滤分离出粗产物.留在滤液中的主要物质是乙酸.
(3)提纯过程中的第③步,过滤要趁热的理由是防止温度降低导致乙酰苯胺析出,降低产率.
(4)提纯过程第⑥步洗涤,下列洗涤剂中最合适的是A.
A.蒸馏水 B.乙醇 C.5%Na2CO3溶液 D.饱和NaCl溶液
(5)从投料量分析,为提高乙酰苯胺产率,甲乙两种方案均采取的措施是乙酸过量;实验结果表明方案甲的产率较高,原因是方案甲将反应过程中生成的水蒸出,促进反应.
19.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
涉及到填写的物质写元素符号或化学式
(1)写出②号形成的单质的电子式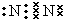 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是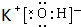 .
.
(3)单质硬度最大的元素是C其氢化物结构式为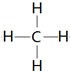 .
.
(4)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥形成的化合物: ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(1)写出②号形成的单质的电子式
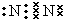 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是
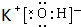 .
.(3)单质硬度最大的元素是C其氢化物结构式为
 .
.(4)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥形成的化合物:
 ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物. 
 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.