题目内容
下列现象不能用氢键解释的是( )
| A、冰的密度小于液态水 |
| B、NH3容易液化 |
| C、HF的沸点高于HI |
| D、有机物普遍存在同分异构现象 |
考点:含有氢键的物质
专题:化学键与晶体结构
分析:N、O、F元素的电负性较强,对应的氢化物可形成氢键,氢键是一种较强的分子间作用力,是由电负性强的原子(如F,O,N)对氢原子的吸引力产生的,能够影响物质的熔点、沸点、密度等,以此解答该题.
解答:
解:A.冰中含有氢键,其体积变大,则质量不变时冰的密度比液态水的密度小,故A不选;
B.氨气分子之间能形成氢键,沸点高,因此易液化,故B不选;
C.HF分子之间能形成氢键,沸点高于HI,故C不选;
D.有机物普遍存在同分异构现象,与碳原子的成键方式等有关,与氢键无关,且很多有机物中不存在氢键,故D选.
故选D.
B.氨气分子之间能形成氢键,沸点高,因此易液化,故B不选;
C.HF分子之间能形成氢键,沸点高于HI,故C不选;
D.有机物普遍存在同分异构现象,与碳原子的成键方式等有关,与氢键无关,且很多有机物中不存在氢键,故D选.
故选D.
点评:本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、100mL 0.1mol?L-1的稀硫酸中含有H+个数为0.2NA |
| B、每1mol Fe被氧化,失去电子数目一定是2NA |
| C、金属钠和氧气反应制取过氧化钠,每生成1mol过氧化钠,转移电子数为4NA |
| D、Zn和稀硫酸反应,每生成1mol氢气转移电子数为2NA |
下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是( )
A、 |
B、 |
C、 |
D、 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A、质量ag的C2H4和C3H6的混合物中共用电子对数目为
| ||
| B、常温下,pH=13的NaOH溶液中含有OH一的数目为0.1NA | ||
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | ||
| D、1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
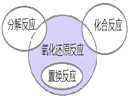 氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )
| A、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
B、4NH3+5O2
| ||||
| C、2NaHCO3=Na2CO3+H2O+CO2↑ | ||||
| D、Cl2+2NaBr=2NaCl+Br2 |
已知糖元[(C6H10O5)n]是一种相对分子质量比淀粉更大的多糖,主要存在肝脏和肌肉中,所以又叫动物淀粉和肝糖.下列关于糖元说法正确的( )
| A、糖元、淀粉、纤维素互为同分异构体 |
| B、糖元与淀粉、纤维素属于同系物 |
| C、糖元水解的最终产物是葡萄糖 |
| D、糖元具有还原性,能发生银镜反应 |
下列叙述能肯定A金属比B金属活泼性强的是( )
| A、A原子的最外层电子数比B原子的最外层电子数多 |
| B、A原子的电子层数比B原子的电子层数多 |
| C、1mol A从酸中置换出的氢比1mol B从酸中转换出的氢多 |
| D、常温下,A能从冷水中置换出氢,而B不能 |
从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )
| A、溴离子具有氧化性 |
| B、氯气是还原剂 |
| C、该反应属于复分解反应 |
| D、氯气是氧化剂 |
