题目内容
19.同温同压下,某容器充满H2S重59g,充满NO2重62g,现充满某气体重58g,则该气体的相对分子量为( )| A. | 46 | B. | 34 | C. | 30 | D. | 60 |
分析 同温同压下,相同容积时,气体的物质的量相同.令气体的物质的量为n,容器质量为m,根据容器充满H2S与NO2的质量,列方程计算n、m的值;根据M=$\frac{m}{n}$可计算气体的摩尔质量,据此计算气体的相对分子质量.
解答 解:令气体的物质的量为n,容器质量为m,则:
m+n×34g/mol=59g,
m+n×46g/mol=62g.
解得,n=0.25mol,m=50.5g.
充满气体后的质量为58g,所以气体的质量为58g-50.5g=7.5g,物质的量为0.25mol.
气体的摩尔质量为$\frac{7.5g}{0.25mol}$=30g/mol.
所以气体的相对分子质量为30.
故选C.
点评 本题考查阿伏伽德罗定律及推论的计算,难度不大,注意相对分子质量的计算方法,计算气体的物质的量是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.认真归纳常见的吸热反应和放热反应并回答,下列变化属于吸热反应的是( )
①加热KClO3和MnO2的混合物制取O2 ②蜡烛的燃烧 ③碳和二氧化碳在高温下反应 ④将氢氧化钡晶体和氯化铵晶体的混合物放入水中 ⑤将碳酸钠晶体和硝酸铵晶体混合均匀放在日光下暴晒 ⑥将黏土、石子、水混合均匀 ⑦将生石灰倒入海水中 ⑧煅烧石灰石.
①加热KClO3和MnO2的混合物制取O2 ②蜡烛的燃烧 ③碳和二氧化碳在高温下反应 ④将氢氧化钡晶体和氯化铵晶体的混合物放入水中 ⑤将碳酸钠晶体和硝酸铵晶体混合均匀放在日光下暴晒 ⑥将黏土、石子、水混合均匀 ⑦将生石灰倒入海水中 ⑧煅烧石灰石.
| A. | ①③④⑤⑧ | B. | ③④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ①②④⑤⑧ |
10.下列各组物质充分反应后,只能得到一种气体的是( )
| A. | 木炭和浓硫酸共热 | B. | 过氧化钠与足量的稀硫酸反应 | ||
| C. | 足量的铜与一定量的浓硝酸反应 | D. | 足量的锌和定量的浓硫酸反应 |
7.为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,该车装着“绿色心脏”--质子交换膜燃料电池,下列叙述正确的是( )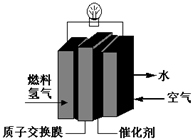

| A. | 总反应式为:O2+2H2═2H2O | |
| B. | 正极的电极反应式为:O2+4H+═2H2O+4e- | |
| C. | 通入氧气的电极发生氧化反应 | |
| D. | 通入氢气的电极为正极 |
14.下列各组仪器常用于物质分离的是( )


| A. | ①③⑥ | B. | ②④⑥ | C. | ②③⑥ | D. | ②③⑤ |
8.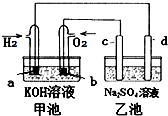 如图用氢氧燃料电池电解硫酸钠溶液(均为惰性电极),下列说法正确的是( )
如图用氢氧燃料电池电解硫酸钠溶液(均为惰性电极),下列说法正确的是( )
 如图用氢氧燃料电池电解硫酸钠溶液(均为惰性电极),下列说法正确的是( )
如图用氢氧燃料电池电解硫酸钠溶液(均为惰性电极),下列说法正确的是( )| 甲池 | 乙池 | |
| A | 放电过程中KOH浓度不变 | 滴加酚酞试液d极区域溶液先变红 |
| B | OH-移向a电极 | OH-移向d电极 |
| C | a电极消耗2.24LH2时 (标准状况) | c电极生成1.12LO2 (标准状况) |
| D | a电极反应:H2-2e-=2H+ | d电极反应:4OH--4e-=O2↑+2H2O |
| A. | A | B. | B | C. | C | D. | D |
9.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1mol NH4+ 含有的电子总数为10NA | |
| B. | 1mol Mg 与足量盐酸反应时失去NA个电子 | |
| C. | 28g N2 所含原子数目为NA | |
| D. | 在101KPa、25℃条件下,11.2L H2 中含有的原子数目为NA |
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.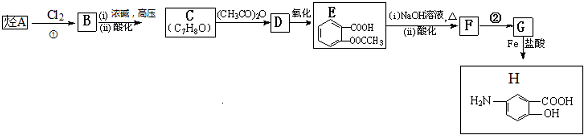
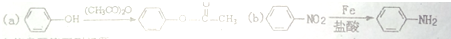
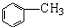 ,F含有的官能团是羧基和酚羟基(填名称).
,F含有的官能团是羧基和酚羟基(填名称).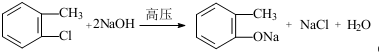 .
.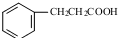 .
.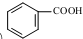 发生取代时,在羧基间位取代;②
发生取代时,在羧基间位取代;②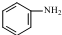 易发生氧化反应.以A为原料合成化合物
易发生氧化反应.以A为原料合成化合物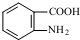 的设计合成路线为(其他试剂任选):
的设计合成路线为(其他试剂任选):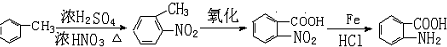 .
.