题目内容
9.下列各组顺序的排列不正确的是( )| A. | 离子半径:F->Na+>Mg2+>Al3+ | B. | 热稳定性:HF>H2O>H2S | ||
| C. | 还原性:F-<Cl-<I- | D. | 碱性强弱:NaOH>KOH>CsOH |
分析 A.核外电子数相同的,原子序数越大,半径越小;
B.非金属性越强,气态氢化物越稳定;
C.非金属性元素的非金属性越强,其对应阴离子的还原性越弱;
D.元素的金属性越强,其对应碱的碱性越强.
解答 解:A.电子层数越多半径越大,核外电子数相同的,原子序数越大,半径越小,F-、Na+、Mg2+、Al3+有2个电子层,原子序数F<Na<Mg<Al,所以离子半径:F->Na+>Mg2+>Al3+,故A正确;
B.非金属性越强,气态氢化物越稳定,非金属性:F>O>S,所以热稳定性:HF>H2O>H2S,故B正确;
C.由于非金属性F>Cl>I,故阴离子的还原性:F-<Cl-<I-,故C正确;
D.元素的金属性越强,其对应最高价氧化物的水化物的碱性越强,即CsOH>KOH>NaOH,故D错误,故选D.
点评 本题考查元素周期律的递变规律,为高频考点,注意把握元素的性质与对应单质、化合物的性质的关系,题目难度不大,学习中注意积累,侧重微粒性质比较的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列除去杂质(括号内为杂质)的方法正确的是( )
①乙烷(乙烯) 光照条件下通入Cl2,气液分离
②乙酸乙酯(乙酸) 用饱和碳酸钠溶液洗涤、分液
③苯(苯酚) 用氢氧化钠溶液洗涤、分液
④乙醇(水) 加足量生石灰、蒸馏.
①乙烷(乙烯) 光照条件下通入Cl2,气液分离
②乙酸乙酯(乙酸) 用饱和碳酸钠溶液洗涤、分液
③苯(苯酚) 用氢氧化钠溶液洗涤、分液
④乙醇(水) 加足量生石灰、蒸馏.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
17.下列关于CO2、SO2以及氮氧化物的说法正确的是( )
| A. | 影响空气质量的一组气体污染物主要是CO2、SO2、NO2 | |
| B. | SO2、氮氧化物的排放会造成酸雨,酸雨的PH≥5.6 | |
| C. | 氮氧化物不仅能形成酸雨,而且还成形成光化学烟雾,破坏臭氧层 | |
| D. | 建高烟囱可以有效降低地面SO2的浓度,从而降低对环境的污染 |
4.如图所示有关浓硫酸性质的实验装置中,实验开始一段时间后,对看到的现象叙述及原因解释都正确的是( )
| A. | 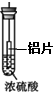 铝片无明显变化,说明浓硫酸与铝片不反应 | |
| B. | 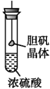 胆矾晶体表面有“白斑”,说明浓硫酸具有脱水性 | |
| C. | 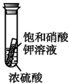 小试管内有晶体析出,说明浓硫酸具有吸水性 | |
| D. | 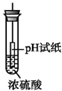 pH试纸变红,说明浓硫酸具有酸性 |
14.将SO2气体通入下列溶液中一定没有沉淀生成的是( )
| A. | 澄清石灰水 | B. | 盐酸酸化的Ba(NO3)2溶液 | ||
| C. | BaCl2溶液 | D. | BaCl2与NaOH的混合溶液 |
1.金属的下列性质中,与自由电子无关的是( )
| A. | 密度大小 | B. | 容易导电 | C. | 延展性好 | D. | 易导热 |
18.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( ) 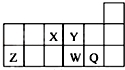

| A. | 元素Y的氢化物比元素X的氢化物稳定 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
19.适当温度下电解H2O-CO2混合气体可制得H2和CO,其电解原理如图所示,下列说法正确的是( )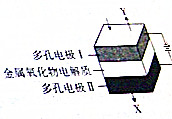

| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |