题目内容
2.含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化: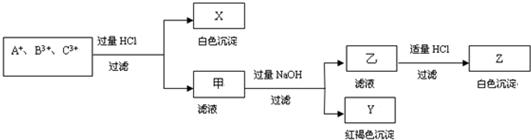
请通过分析回答(用化学符号填写):
(1)A+是Ag+,B3+是Fe3+或Al3+,C3+是Al3+或Fe3+;
(2)X是AgCl,Y是Fe(OH)3,Z是Al(OH)3;
(3)写出有关离子方程式:
①生成Y沉淀:Fe3++3OH-=Fe(OH)3↓;
②生成Z沉淀:AlO2-+H++H2O=Al(OH)3↓.
分析 含有A+、B3+、C3+ 三种金属阳离子的水溶液,加入过量盐酸反应过滤得到白色沉淀X和滤液甲,白色沉淀只能是氯化银沉淀,说明A+离子为Ag+,滤液甲中加入过量氢氧化钠溶液过滤得到红褐色沉淀Y为Fe(OH)3,滤液乙中加入适量盐酸反应生成白色沉淀Z为Al(OH)3,说明B3+、C3+ 离子分别为:Fe3+、Al3+或Al3+、Fe3+,据此回答问题.
解答 解:含有A+、B3+、C3+ 三种金属阳离子的水溶液,加入过量盐酸反应过滤得到白色沉淀X和滤液甲,白色沉淀只能是氯化银沉淀,说明A+离子为Ag+,滤液甲中加入过量氢氧化钠溶液过滤得到红褐色沉淀Y为Fe(OH)3,滤液乙中加入适量盐酸反应生成白色沉淀Z为Al(OH)3,说明B3+、C3+ 离子分别为:Fe3+、Al3+或Al3+、Fe3+,
(1)上述分析可知A+、B3+、C3+ 三种金属阳离子分别为:Ag+、Fe3+、Al3+或Ag+、Al3+、Fe3+,
故答案为:Ag+、Fe3+、Al3+或Ag+、Al3+、Fe3+;
(2)分析可知对应X、Y、Z分别为:AgCl、Fe(OH)3、Al(OH)3,
故答案为:AgCl; Fe(OH)3;Al(OH)3;
(3)①生成Y沉淀的离子方程式为:Fe3++3OH-=Fe(OH)3↓,②生成Z沉淀的反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,
故答案为:Fe3++3OH-=Fe(OH)3↓; AlO2-+H++H2O=Al(OH)3↓.
点评 本题考查了常见离子的检验,题目难度中等,注意掌握常见离子的反应现象及检验方法,明确硫化铜不溶于稀盐酸、铁离子能够与氯化氢发生氧化还原反应是解题关键.

练习册系列答案
相关题目
17.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=(+283.0kJ/mol)×2 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
14.关于阿司匹林在临床上的应用,下列说法正确的是( )
| A. | 阿司匹林有解热阵痛的作用 | |
| B. | 服用阿司匹林后出现肠胃道反应是中毒的表现,应立即停药 | |
| C. | 阿司匹林在干燥空气中不稳定,所以通常制成肠溶片 | |
| D. | 阿司匹林有治疗癌症的作用 |
12.下列变化是化学变化的是( )
| A. | 山体滑坡 | B. | 铁生锈 | C. | 冰变成水 | D. | 碘单质升华 |
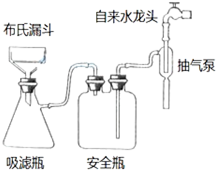 某学生预测定味精(味精的主要成分化学式为C5H8NO4Na•H2O)中食盐的含量,做了如下实验:
某学生预测定味精(味精的主要成分化学式为C5H8NO4Na•H2O)中食盐的含量,做了如下实验: .
.
 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: