题目内容
10.A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大.已知A原子核外有三个未成对电子;B的最外层电子数是内层电子数的3倍;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;R原子核外最外层电子数与C相同,其余各层均充满.请根据以上信息,回答下列问题:(1)A、B、C、D四种原子的第一电离能由小到大的顺序为Na、Si、O、N(或Na<Si<O<N)(用元素符号表示).
(2)C的氯化物的熔点比D的氯化物的熔点高,理由是NaCl是离子晶体而SiCl4是分子晶体.
(3)基态R+离子的核外电子排布式是1s22s22p63s23p63d10或〔Ar〕3d10 .
(4)Q分子是A2B的等电子体,Q的结构式为O=C=O或S=C=S.
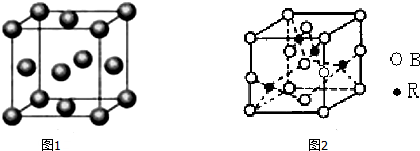
(5)图一是R单质的晶胞结构,配位数为12;图二是B、R两元素组成的一种化合物的晶胞,其化学式为CuO.
分析 A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大;B的最外层电子数是内层电子数的3倍,最外层电子数不超过8个,则其最外层电子数是6,其内层电子数是2,B为O元素;A原子核外有三个未成对电子,且原子序数小于B,则A是N元素;
E原子核外的M层中只有两对成对电子,则E是S元素;D单质的熔点在同周期单质中最高,且D原子序数小于E,则D是Si元素;
化合物C2E的晶体为离子晶体,E是S元素,则C是Na元素;
R原子核外最外层电子数与C相同,其余各层均充满,则R是Cu元素;
(1)元素的非金属性越强,其第一电离能越大,同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)离子晶体熔沸点高于分子晶体;
(3)Cu原子失去最外层1个电子生成亚铜离子,根据构造原理书写亚铜离子核外电子排布式;
(4)原子个数相等且价电子数相等的微粒互为等电子体;
(5)该晶胞中Cu原子配位数=3×8÷2;该晶胞中Cu原子个数为4,O原子个数=1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,根据Cu、O原子个数之比确定化学式.
解答 解:A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大;B的最外层电子数是内层电子数的3倍,最外层电子数不超过8个,则其最外层电子数是6,其内层电子数是2,B为O元素;A原子核外有三个未成对电子,且原子序数小于B,则A是N元素;
E原子核外的M层中只有两对成对电子,则E是S元素;D单质的熔点在同周期单质中最高,且D原子序数小于E,则D是Si元素;
化合物C2E的晶体为离子晶体,E是S元素,则C是Na元素;
R原子核外最外层电子数与C相同,其余各层均充满,则R是Cu元素;
(1)元素的非金属性越强,其第一电离能越大,同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这几种元素第一电离能从小到大顺序是Na、Si、O、N(或Na<Si<O<N),故答案为:Na、Si、O、N(或Na<Si<O<N);
(2)C的氯化物是NaCl,为离子晶体,D的氯化物SiCl4为分子晶体,离子晶体熔沸点高于分子晶体,所以C的氯化物熔点高于D的氯化物,故答案为:NaCl是离子晶体而SiCl4是分子晶体;
(3)Cu原子失去最外层1个电子生成亚铜离子,根据构造原理书写亚铜离子核外电子排布式为1s22s22p63s23p63d10或〔Ar〕3d10 ,
故答案为:1s22s22p63s23p63d10或〔Ar〕3d10 ;
(4)原子个数相等且价电子数相等的微粒互为等电子体,Q分子是N2O的等电子体,为CO2分子或CS2,其结构式为O=C=O或 S=C=S,故答案为:O=C=O或 S=C=S;
(5)该晶胞中Cu原子配位数=3×8÷2;该晶胞中Cu原子个数为4,O原子个数=1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,Cu、O原子个数之比=4:4=1:1,所以其化学式为CuO,
故答案为:12;CuO.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子核外电子排布、等电子体、元素周期律等知识点,侧重考查学生知识运用及分析解答问题能力,注意第一电离能规律中的反常现象,题目难度不大.

| A. | 液化石油气和天然气的主要成分都是甲院 | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 煤的气化是化学变化,石油分馏是物理变化 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 1molSO2、0.5molO2 | 2molSO3 |
| k1 | k2 | k3 | |
| 反应的能量变化 | 放出akJ | 放出bkJ | 吸收ckJ |
| 气体密度 | ρ1 | ρ2 | ρ3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | k1=k3<k2 | B. | ρ1=ρ3>ρ2 | C. | α2+α3>1 | D. | 2b+c>197 |
| A. | 得出完整的元素周期表 | B. | 发现了元素周期律 | ||
| C. | 发现空气的组成 | D. | 提出原子、分子学说 |
| A. | .用10mL量筒量取7.28mL稀盐酸 | |
| B. | .用托盘天平称量25.50g NaCl | |
| C. | 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.60mL | |
| D. | 用广泛pH试纸测得某溶液的pH为2.7 |
| A. | 正极 | B. | 负极 | C. | 阴极 | D. | 阳极 |