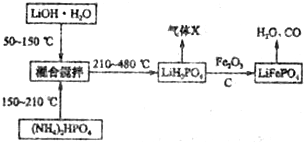
题目内容
2.目前市场上碱锰电池不能满足需大电流大容量用电的数码相机、摄影机等电子产品的需要,锂离子电池因成本在此方面不具很强的竞争力.而高铁电池能量密度大、体积小、重量轻、寿命长、无污染.功率是民用电池的10~15倍,放电电流是普通电池的3~10倍,性价比极高.已知,以 Zn和K2FeO4为电极材料制作的高铁电池放电时,电池内发生的总反应为:□Zn+□K2FeO4=□ZnO+□Fe2O3+□K2ZnO2(1)配平上面的化学方程式3Zn+2K2FeO4=ZnO+Fe2O3+2K2ZnO2.
(2)该电池的负极电极反应式为3Zn-6e-+10OH-=ZnO+2ZnO22-+5H2O.放电时负极附近溶液的pH变化是减小(填“增大”、“减小”、“不变”).
(3)已知铁是26号元素,则1mol FeO42-中含有电子的物质的量为60mol,Na2FeO4是否具有还原性有,原因是K2FeO4中O元素为-2价,化合价可以升高,表现还原性.
(4)制备高铁酸钾可以将Fe(OH)3在碱性条件下与KClO溶液反应,若将该反应设计为原电池,则此电池的负极反应方程式为5OH-+Fe(OH)3-3e-=FeO42-+4H2O.
(5)向1L 1mol/L的K2FeO4中加入足量稀H2SO4酸化,可以产生O2和Fe3+,该反应的离子方程式为4FeO42-+20H+=4Fe3++3O2↑+10H2O.向酸化后溶液中加入一定量的金属铜,使Fe3+和Cu2+浓度相等,若此时溶液密度为1.25g/mL,体积仍为1L,则此时溶液中Cu元素的质量分数约为1.71%.(精确到0.01)
分析 (1)根据氧化还原反应得失电子数目相等,可判断出Zn和K2FeO4的化学计量数分别为3和2,再根据原子守恒配平方程式;
(2)Zn为电池负极材料,失电子发生氧化反应生成ZnO和ZnO2-,用OH-浓度的变化分析电极附近溶液pH;
(3)1mol FeO42-中含有e-数等于26+8×4+2=60mol,元素化合价可以升高就能表现还原性;
(4)负极发生氧化反应,Fe(OH)3中+3价Fe被氧化为FeO42-,根据电荷守恒配平电极反应式;
(5)-2价O被氧化为O2,+6价Fe元素被还原为Fe3+,根据氧化还原反应配平离子方程式;Cu加入反应后的溶液发生反应,2Fe3++Cu=2Fe2++Cu2+,假设n(Cu2+)=x mol,则反应了的n(Fe3+)=2x mol,根据题意列式解x,最后计算质量分数.
解答 解:(1)Zn从0价到+2价升高2价,Fe从+6价到+3价下降了3价,可判断出Zn和K2FeO4的化学计量数分别为3和2,同时根据K和Fe原子个数守恒得出产物Fe2O3和K2ZnO2的化学计量数分别为1和2,则ZnO的计量数为2,故答案为:3Zn+2K2FeO4=ZnO+Fe2O3+2K2ZnO2;
(2)Zn为电池负极材料,电极反应式为3Zn-6e-+10 OH-=ZnO+2ZnO22-+5H2O,消耗了溶液中OH-,氢氧根浓度减小,所以该电极附近溶液pH将减小,
故答案:3Zn-6e-+10OH-=ZnO+2ZnO22-+5H2O; 减小;
(3)1mol FeO42-中含有e-数等于26+8×4+2=60mol,Na2FeO4中-2价O化合价可以升高,能表现还原性,
故答案为:60;有;K2FeO4中O元素为-2价,化合价可以升高,表现还原性;
(4)负极发生氧化反应,Fe(OH)3中+3价Fe被氧化为FeO42-,碱性环境用OH-保证电荷守恒,用水保证H和O守恒配平得到负极反应式:5OH-+Fe(OH)3-3e-=FeO42-+4H2O,故答案为:5OH-+Fe(OH)3-3e-=FeO42-+4H2O;
(5)-2价O被氧化为O2,+6价Fe元素被还原为Fe3+,用H+保证电荷守恒,用H2O保证H和O守恒,则离子方程式为:4FeO42-+20H+=4Fe3++3O2↑+10H2O,
Cu加入反应后的溶液发生反应,2Fe3++Cu=2Fe2++Cu2+,假设n(Cu2+)=x mol,则反应了的n(Fe3+)=2x mol,根据题意列等式得:1-2x=x,则x=1/3mol,故反应后溶液中Cu元素的质量分数ω=$\frac{m(Cu)}{m(溶液)}$×100%=$\frac{64g/mol×\frac{1}{3}mol}{1.25g/mL×1000mL}$=1.71%,故答案为:1.71%.
点评 本题考查氧化还原反应,原电池的工作原理的应用,电极反应,电极产物的判断等,混合物质量分数计算,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 溴化亚铁溶液中滴加少量氯水:2Br-+Cl2=Br2+2Cl- | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| C. | NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
| A. | 50g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| B. |  12g石墨烯(如图)中含有C-C键的数目为1.5NA 12g石墨烯(如图)中含有C-C键的数目为1.5NA | |
| C. | 常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 一定量的Na2O2与H2O反应产生1.12L O2,则反应中转移的电子数为0.1NA |
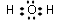 .
.