题目内容
12.水是生命之源,也是化学反应中的主角.试回答下列问题:(1)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:3NO2+H2O=2HNO3+NO;Cl2+H2O=HCl+HClO;2Na2O2+2H2O=4NaOH+O2.
(2)写出水的电子式
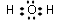 .
.
分析 (1)二氧化氮、氯气、过氧化钠均与水反应,发生氧化还原反应,但水既不是氧化剂也不是还原剂;
(2)水为共价化合物.
解答 解:(1)二氧化氮为红棕色气体、氯气为黄绿色气体、过氧化钠为淡黄色固体,均由短周期元素组成,三种物质均与水反应,发生氧化还原反应,但水既不是氧化剂也不是还原剂,发生的反应分别为3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2,
故答案为:3NO2+H2O=2HNO3+NO;Cl2+H2O=HCl+HClO;2Na2O2+2H2O=4NaOH+O2;
(2)水为共价化合物,只含H-O共价键,其电子式为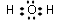 ,故答案为:
,故答案为: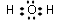 .
.
点评 本题考查无机物的推断,为高频考点,把握常见物质的性质、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
相关题目
2.对于某些离子的检验方法(包括操作、现象、结论),完全正确的是( )
| A. | 向待测溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 向待测溶液中逐滴加入氢氧化钠溶液,开始有白色沉淀生成,继续滴加氢氧化钠溶液到过量,沉淀逐渐溶解,一定有 Al3+ | |
| C. | 向待测溶液中先滴加盐酸酸化未出现沉淀,再加入 BaCl2 溶液有白色沉淀产生,一定有SO42- | |
| D. | 向待测溶液中滴加 NaOH 溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ |
3. 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液.整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中 $\frac{c({H}^{+})}{c(O{H}^{-})}$ 减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-) |
4.下列微粒中:①12Mg2+ ②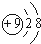 ③NH4+ ④O2-,核外电子总数相同的是( )
③NH4+ ④O2-,核外电子总数相同的是( )
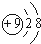 ③NH4+ ④O2-,核外电子总数相同的是( )
③NH4+ ④O2-,核外电子总数相同的是( )| A. | ②③④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
1.为鉴别卤代烃中所含卤素原子,现有下列实验操作步骤,正确的顺序是( )
①加入AgNO3溶液 ②加入少许卤代烃试样 ③加热 ④加入5mL 4mol•L-1 NaOH溶液 ⑤加入5mL 4mol•L-1 HNO3溶液.
①加入AgNO3溶液 ②加入少许卤代烃试样 ③加热 ④加入5mL 4mol•L-1 NaOH溶液 ⑤加入5mL 4mol•L-1 HNO3溶液.
| A. | ②④③①⑤ | B. | ②③①④⑤ | C. | ②④③⑤① | D. | ②⑤③①④ |
 ②Na2O2
②Na2O2 ③N2
③N2 ④H2O
④H2O .
.