题目内容
已知:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2 220.0kJ/mol
H2O(l)═H2O(g)△H2=44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式: .
H2O(l)═H2O(g)△H2=44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式:
考点:用盖斯定律进行有关反应热的计算
专题:
分析:利用已知反应,据盖斯定律书写热化学方程式.
解答:
解:已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2 220.0kJ/mol
②H2O(l)═H2O(g)△H2=44.0kJ/mol
据盖斯定律①+-4×②得:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2044.0kJ/mol
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2044.0kJ/mol.
②H2O(l)═H2O(g)△H2=44.0kJ/mol
据盖斯定律①+-4×②得:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2044.0kJ/mol
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H1=-2044.0kJ/mol.
点评:本题考查了盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2O,Ag2O+2e-+H2O=2Ag+2OH-.椐此判断下列叙述中正确的是( )
| A、电池放电时,电池负极区溶液的碱性增强 |
| B、电池放电时,电子从Ag2O电极经外电路流向Zn电极 |
| C、Zn电极为负极,被氧化;Ag2O电极为正极,被还原 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
质子核磁共振谱(PMR)是研究有机物分子结构的有效方法之一,每一结构中的等性氢原子在PMR谱都给出了相应的峰(信号),峰的强度与结构中的H原子数成正比.那么,甲酸乙酯在PMR谱中的信号和强度分别应该是( )
| A、两个信号,强度之比为1:1 |
| B、三个信号,强度之比为1:1:1 |
| C、两个信号,强度之比为3:1 |
| D、三个信号,强度之比为3:2:1 |
下列分子中键角最大的是( )
| A、CH4 |
| B、NH3 |
| C、H2O |
| D、CO2 |
下列说法正确的是( )
| A、在所有元素中,氟的电离能最大 |
| B、铝的第一电离能比镁的第一电离能大 |
| C、第3周期所含的元素中钠的第一电离能最小 |
| D、钾的第一电离能比镁的第一电离能大 |
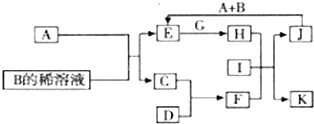 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.