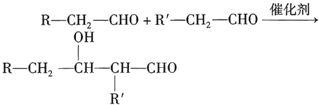
题目内容
(1)写出醋酸的电离方程式:
(2)取稀氨水进行下列操作,则NH3、NH4+、OH-浓度如何变化?
①通适量HCl气体时,c(NH3) .(填写“增大”“减小”“不变”.下同)
②加入少量NaOH固体时,c(NH4+) .
③加入NH4Cl晶体时,c(OH-) .
④加水稀释,NH3.H2O的电离度 .
(2)取稀氨水进行下列操作,则NH3、NH4+、OH-浓度如何变化?
①通适量HCl气体时,c(NH3)
②加入少量NaOH固体时,c(NH4+)
③加入NH4Cl晶体时,c(OH-)
④加水稀释,NH3.H2O的电离度
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)醋酸是弱电解质,在水溶液里部分电离出醋酸根离子与氢离子;
(2)①通入适量HCl,氢离子和氢氧根离子反应生成水促进NH3?H2O电离;
②加入少量NaOH固体,c(OH-)增大抑制NH3?H2O电离;
③加入氯化铵晶体,c(NH4+)增大抑制NH3?H2O电离;
④加水稀释,电离程度变大.
(2)①通入适量HCl,氢离子和氢氧根离子反应生成水促进NH3?H2O电离;
②加入少量NaOH固体,c(OH-)增大抑制NH3?H2O电离;
③加入氯化铵晶体,c(NH4+)增大抑制NH3?H2O电离;
④加水稀释,电离程度变大.
解答:
解:(1)醋酸是弱电解质,在水溶液里部分电离,电离方程式为:CH3COOH?H++CH3COO-,故答案为:CH3COOH?H++CH3COO-;
(2)①通入适量HCl,H+和OH-反应生成水促进NH3?H2O电离,所以溶液中c(NH3)减小,故答案为:减小;
②加入少量NaOH固体,c(OH-)增大抑制NH3?H2O电离,则c(NH4+)减小,故答案为:减小;
③加入氯化铵晶体,c(NH4+)增大抑制NH3?H2O电离,则c(OH-)减小,故答案为:减小;
④加水稀释,电离程度变大,所以NH3.H2O的电离度增大,故答案为:增大.
(2)①通入适量HCl,H+和OH-反应生成水促进NH3?H2O电离,所以溶液中c(NH3)减小,故答案为:减小;
②加入少量NaOH固体,c(OH-)增大抑制NH3?H2O电离,则c(NH4+)减小,故答案为:减小;
③加入氯化铵晶体,c(NH4+)增大抑制NH3?H2O电离,则c(OH-)减小,故答案为:减小;
④加水稀释,电离程度变大,所以NH3.H2O的电离度增大,故答案为:增大.
点评:本题影响电离方程式的书写以及弱电解质电离因素,明确改变条件时哪些微粒改变引起平衡移动是解本题关键,注意(2)中如果加入水会促进一水合氨电离,题目难度不大.

练习册系列答案
相关题目
铜和镁的合金4.6g完全溶于浓硝酸,若反应后硝酸被还原只产生 2.24L的 NO2气体和1.12L的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
| A、9.02g |
| B、8.51g |
| C、8.00g |
| D、7.04g |
钢铁制品表面镀铝既美观又能防腐.镀铝时选用的阳极材料是( )
| A、Zn |
| B、Fe |
| C、Al |
| D、AlCl3 |
X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时最外层的电子排布可能是( )
| A、X:3s23p1 Y:3s23p5 |
| B、X:2s22p3 Y:2s22p5 |
| C、X:3s23p1 Y:3s23p4 |
| D、X:3s2 Y:2s22p3 |
定容容器A与定压容器B的体积开始时相同,内皆装有同质量、同物质的量之比的SO2与O2混合气体,经一定时间在相同温度下达到平衡.有关叙述正确的是( )
| A、A、B中SO2的转化率相同 |
| B、B中的反应速率比A中快 |
| C、A中SO2的转化率比B中高 |
| D、若A、B中皆再加入同量的氩气,平衡不移动 |
能源可划分为一级能源和二级能源.自然界中以现成形式提供的能源称为一级能源,需依靠其它能源的能量间接制取的能源成为二级能源.下列能源是一级能源的是( )
| A、电能 | B、太阳能 |
| C、氢气 | D、水煤气 |