题目内容
2.根据如图所示情况,判断下列说法中正确的是( )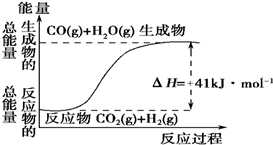
| A. | 其热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 若当H2O为液态时反应热为△H2,则△H2>△H |
分析 由图象可知反应物的总能量小于生成物的总能量,为吸热反应,由图象可知反应热为+41kJ•mol-1,以此解答该题.
解答 解:由图象可知反应物的总能量小于生成物的总能量,为吸热反应,由图象可知反应热为+41kJ•mol-1,CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1,故A、C错误;B正确;
气体变为液体放热,若当H2O为液态时反应热为△H2,则吸收的热量较少,△H2<△H,故D错误.
故选B.
点评 本题考查反应热与焓变,为高频考点,侧重于学生的分析能力的考查,题目难度不大,明确热化学方程式的表示的意义及书写原则为解答关键,注意焓变数值大小与吸热、放热反应的关系,为易错点.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
17.下列物质加入水中显著放热的是( )
| A. | 生石灰 | B. | 固体NaCl | C. | 蔗糖 | D. | 固体NH4NO3 |
14.在下列四种反应条件下,锌和盐酸反应速率最快的是( )
| A. | 20℃时,将锌片放入0.01 mol•L-1的稀盐酸中 | |
| B. | 20℃时,将锌片放入0.1 mol•L-1的稀盐酸中 | |
| C. | 50℃时,将锌片放入0.01 mol•L-1的稀盐酸中 | |
| D. | 50℃时,将锌片放入0.1 mol•L-1的稀盐酸中 |
11.常温下将盛有10mL NO2和10mL NO的混合气体的试管倒立于水槽中,并向其中通入O2一段时间后,试管内还剩余2mL气体,则通入O2的体积为( )
| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 13mL |
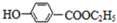 ,下列反应①-⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明.
,下列反应①-⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明.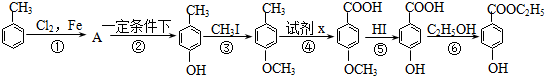 ).
).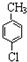 .A的名称为对氯甲苯.
.A的名称为对氯甲苯.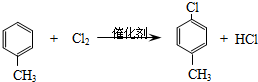 .
. .
. 的同分异构体中,既能与NaHCO3发生反应,又能与FeCl3溶液发生显色反应的共有13种,其中核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的为
的同分异构体中,既能与NaHCO3发生反应,又能与FeCl3溶液发生显色反应的共有13种,其中核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的为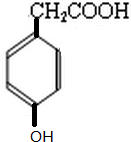 (写结构简式).
(写结构简式).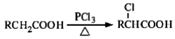 ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备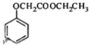 的合成路线流程图(无机试剂任用).合成路线流程图例如下:
的合成路线流程图(无机试剂任用).合成路线流程图例如下: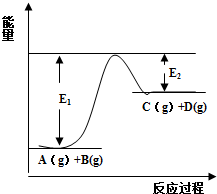 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.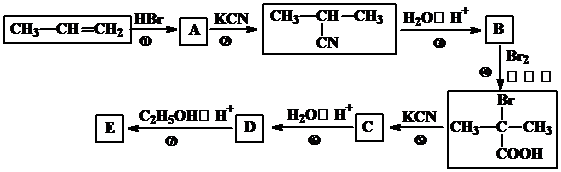
 .
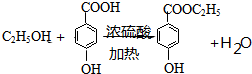
.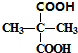 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.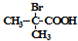 与足量NaOH乙醇溶液反应的化学方程式为
与足量NaOH乙醇溶液反应的化学方程式为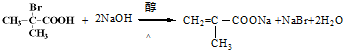 .
. 、
、 .
.