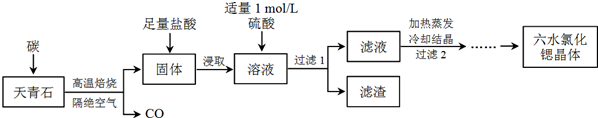
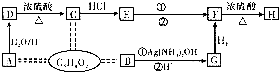
题目内容
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,下列溶液沸点最高的是( )
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.02 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的氨水 |
考点:电解质在水溶液中的电离
专题:
分析:根据溶液中非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,则假设溶液为1L时计算选项中溶质的物质的量来比较即可解答.
解答:
解:A、因1L蔗糖溶液中蔗糖的物质的量为1L×0.01mol/L=0.01mol;
B、因1LCaCl2溶液溶质的离子的总物质的量为1L×0.01mol/L×3=0.03mol;
C、因1LNaCl溶液中溶质的离子的总物质的量为1L×0.02mol/L×2=0.04mol;
D、因氨水是挥发性溶质,且1L溶液中分子的物质的量为1L×0.02mol/L=0.02mol;
显然C中含0.04 mol离子,离子数最多,
故选:C.
B、因1LCaCl2溶液溶质的离子的总物质的量为1L×0.01mol/L×3=0.03mol;
C、因1LNaCl溶液中溶质的离子的总物质的量为1L×0.02mol/L×2=0.04mol;
D、因氨水是挥发性溶质,且1L溶液中分子的物质的量为1L×0.02mol/L=0.02mol;
显然C中含0.04 mol离子,离子数最多,
故选:C.
点评:本题考察角度新颖,利用非挥发性溶质的分子或离子数来判断溶液的沸点高低,学生熟悉物质的量浓度的有关计算是解答的关键,并会判断挥发性物质来解答即可.

练习册系列答案
相关题目
把0.05molNaOH固体分别加入到100mL液体中,溶液的导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1硝酸 |
| D、0.5mol?L-1NaCl溶液 |
能用H++OH-=H2O来表示的化学反应是( )
| A、氢氧化铜和稀盐酸反应 |
| B、氢氧化钡溶液滴入稀硫酸中 |
| C、氢氧化钠溶液与硝酸反应 |
| D、醋酸和氢氧化钾溶液 |
下列叙述正确的是( )
| A、NaCl溶液在电流的作用下电离出Na+ |
| B、离子化合物一定是电解质 |
| C、氨水呈弱碱性,故NH3是弱电解质 |
| D、溶于水电离出氢离子的化合物都是酸 |
 化合物A是一种热稳定性较差的无水的弱酸钠盐.用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程.
化合物A是一种热稳定性较差的无水的弱酸钠盐.用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程.