题目内容
10.X、Y、Z、M、R、Q为原子序数依次增大的六种短周期元素,其原子半径及主要化合价如下表:( )| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(×10-10m) | 0.37 | 0.75 | 0.74 | 1.86 | 1.43 | 0.99 | |
| 主要化合价 | 最高正价 | +1 | +5 | +1 | +3 | +7 | |
| 最低负价 | -1 | -3 | -2 | -1 | |||
| A. | Z的氢化物的稳定性都大于Y的氢化物 | |
| B. | 化合物XQ、MQ都是电解质,熔融状态下都能电解 | |
| C. | 元素M、Q、Z的简单离子半径:r(M+)>r(Q-)>r(Z2-) | |
| D. | 在一定条件下,R可以溶于M、Y两种元素的最高价氧化物的水化物的浓溶液 |
分析 短周期元素,由元素的化合价可知,Z只最低负价为-2价,Z是O;Y有最高正价+5价,在第ⅤA族,且半径比Z大,所以Y是N;Q为最高正价为+7价,并有最低负价,则Q不是F,只能是Cl;X、M均有+1价,处于ⅠA族,且X原子半径较小,且有最低负价-1价,则X是H;M、R、Q的半径比X、Y、Z的大,应在第三同期,则M是Na;R的最高正价是+3价,处于ⅢA族,只能是Al,据此解答.
解答 解:据分析可知:X、Y、Z、M、R、Q分别是H、N、O、Na、Al、Cl,
A.Z是O,Y是N,一般的比较方法是同周期从左到右非金属性增强,对应的气态氢化物稳定性增强,但O的氢化物除水外还有双氧水,双氧水不稳定,故A错误;
B.化合物XQ、MQ分别是HCl、NaCl,它们都是电解质,但熔融状态下只有离子化合物NaCl能导电,可以电解,故B错误;
C.元素M、Q、Z的简单离子分别是Na+、Cl-、O2-,一般电子层数多半径大,所以离子半径最大是3层的Cl-,当电子层结构相同时,原子序数小的半径反而大,所以O2-半径大于Na+半径,故C错误;
D.在一定条件下,R是铝,M、Y两种元素的最高价氧化物的水化物分别是氢氧化钠、硝酸,铝可以溶于强酸、强碱,故D正确;
故选D.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,注意对元素周期律的理解掌握.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
1.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,
甲:500℃,10mol SO2和5mol O2反应;
乙:500℃,V2O5作催化剂,10mol SO2和5mol O2反应;
丙:450℃,8mol SO2和5mol O2反应;
丁:500℃,8mol SO2和5mol O2反应,
开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500℃,10mol SO2和5mol O2反应;
乙:500℃,V2O5作催化剂,10mol SO2和5mol O2反应;
丙:450℃,8mol SO2和5mol O2反应;
丁:500℃,8mol SO2和5mol O2反应,
开始反应时,按反应速率由大到小的排列顺序正确的是( )
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丙、丁 | C. | 乙、甲、丁、丙 | D. | 丁、丙、乙、甲 |
18.已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
则表中x为( )
| O═O | H-H | H-O(g) | |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
| A. | 920 | B. | 557 | C. | 463 | D. | 188 |
5.下列说法中正确的是( )
| A. | 乙烯、1,3-丁二烯、聚乙烯均能与溴水发生加成反应 | |
| B. | 实验室中要除去乙烷中混有的乙烯气体,可以用通入H2催化加氢的方法 | |
| C. | 沸点由高到低依次为:正戊烷>异戊烷>新戊烷>正丁烷>异丁烷 | |
| D. | 室温光照条件下,可以用CH4与氯气制取纯净的一氯甲烷,该反应属于取代反应 |
2. 科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
 科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )| A. | 阴极的电极反应是N2+6H++6e-=2NH3 | |
| B. | 阴极材料和阳极材料都可选用铁 | |
| C. | H2在阳极上发生反应是H2-2e-=2H+ | |
| D. | 该过程的总反应式是N2+3H2$\frac{\underline{\;电解\;}}{\;}$2NH3 |
19.某元素构成的双原子单质分子有三种,其式量分别为158、160、162.在天然单质中,此三种单质的物质的量之比为1:1:1,由此推断以下结论中,正确的是( )
| A. | 此元素有三种同位素 | |
| B. | 其中一种同位素质量数为80 | |
| C. | 其中质量数为79的同位素原子占原子总数的$\frac{1}{3}$ | |
| D. | 此元素的单质的平均式量为160 |
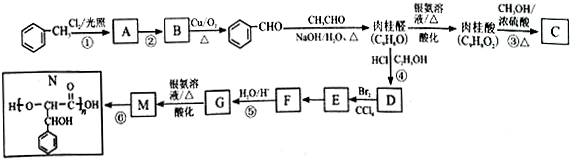
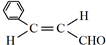 .
. .
.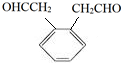 .
.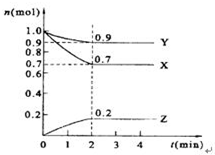 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.