题目内容
2. 科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )| A. | 阴极的电极反应是N2+6H++6e-=2NH3 | |
| B. | 阴极材料和阳极材料都可选用铁 | |
| C. | H2在阳极上发生反应是H2-2e-=2H+ | |
| D. | 该过程的总反应式是N2+3H2$\frac{\underline{\;电解\;}}{\;}$2NH3 |
分析 电解时,阳极上失电子发生氧化反应,反应式为3H2-6e-=6H+,阴极上得电子发生还原反应,反应式为N2+6H++6e-=2NH3,则电池反应式为N2+3H2 $\frac{\underline{\;通电\;}}{\;}$2NH3,据此分析解答.
解答 解:A.电解时,N2在阴极上得电子被还原,阴极反应式为N2+6H++6e-=2NH3,故A正确;
B.如果Fe作阳极,是活性电极,阳极上铁失电子而不是氢气失电子,所以阳极应该是惰性电极,故B错误;
C.H2在阳极上发生氧化反应,电极反应式为:H2-2e-=2H+,故C正确;
D.阳极反应式为3H2-6e-=6H+,阴极反应式为N2+6H++6e-=2NH3,则电池反应式为N2+3H2 $\frac{\underline{\;通电\;}}{\;}$2NH3,故D正确;
故选B.
点评 本题考查了电解原理,明确电解池电极的判断,会正确书写电极反应式,注意题干中交换膜为质子导体的含义,题目难度中等.

练习册系列答案
相关题目
12.在粗盐提纯的实验中,操作正确的是( )
| A. | 把浑浊的液体倒入蒸发皿中加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 待水分完全蒸干后停止加热 | |
| D. | 蒸干水分后用玻璃棒转移固体至滤纸上 |
10.X、Y、Z、M、R、Q为原子序数依次增大的六种短周期元素,其原子半径及主要化合价如下表:( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(×10-10m) | 0.37 | 0.75 | 0.74 | 1.86 | 1.43 | 0.99 | |
| 主要化合价 | 最高正价 | +1 | +5 | +1 | +3 | +7 | |
| 最低负价 | -1 | -3 | -2 | -1 | |||
| A. | Z的氢化物的稳定性都大于Y的氢化物 | |
| B. | 化合物XQ、MQ都是电解质,熔融状态下都能电解 | |
| C. | 元素M、Q、Z的简单离子半径:r(M+)>r(Q-)>r(Z2-) | |
| D. | 在一定条件下,R可以溶于M、Y两种元素的最高价氧化物的水化物的浓溶液 |
7.在下列元素中,不属于主族元素的是( )
| A. | 铁 | B. | 钙 | C. | 磷 | D. | 碘 |
14.对于可逆反应N2+3H2?2NH3下列各项所表示的反应速率最快的是( )
| A. | ν(N2)=0.02 mol•L-1•s-1 | B. | ν(H2)=0.2 mol•L-1•s-1 | ||
| C. | ν(H2)=0.6 mol•L-1•min-1 | D. | ν(NH3)=1.2 mol•L-1•min-1 |
12.把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,d上有气泡逸出;a、c相连时,a极减轻;b、d相连时,b为正极.则这四种金属活泼性顺序由强到弱的顺序为( )
| A. | a>b>c>d | B. | a>c>b>d | C. | a>c>d>b | D. | b>d>a>c |
 (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)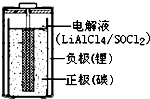 亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃
亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃