题目内容
下列实验装置或操作正确的是( )
A、 转移溶液 |
B、 除去氯气中氯化氢 |
C、 点燃酒精灯 |
D、 称量NaOH固体 |
考点:化学实验方案的评价
专题:
分析:A.向容量瓶中转移液体,应用玻璃棒引流;
B.气体应从长导管进;
C.点燃酒精灯,应防止失火;
D.氢氧化钠应放在左盘,且放在小烧杯中称量.
B.气体应从长导管进;
C.点燃酒精灯,应防止失火;
D.氢氧化钠应放在左盘,且放在小烧杯中称量.
解答:
解:A.向容量瓶中转移液体,应用玻璃棒引流,以防止液体流出,故A正确;
B.气体应从长导管进,否则导致洗气瓶压强过大,故B错误;
C.点燃酒精灯,应防止失火,不能用另一酒精灯引燃,故C错误;
D.氢氧化钠应放在左盘,因氢氧化钠具有吸潮性和腐蚀性,应放在小烧杯中称量,故D错误.
故选A.
B.气体应从长导管进,否则导致洗气瓶压强过大,故B错误;
C.点燃酒精灯,应防止失火,不能用另一酒精灯引燃,故C错误;
D.氢氧化钠应放在左盘,因氢氧化钠具有吸潮性和腐蚀性,应放在小烧杯中称量,故D错误.
故选A.
点评:本题考查较为综合,涉及溶液的配制、洗气、酒精灯的使用以及物质的称量,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的可行性和严密性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为确定某溶液的离子组成,进行实验:根据以上实验,以下对原溶液的推测正确的是( )
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
| A、一定有CO32-离子存在 |
| B、不能确定是否存在HCO3-离子存在 |
| C、一定有C1-离子存在 |
| D、一定有SO32-离子存在 |
下列说法正确的是( )
| A、HR溶液的导电性较弱,所以HR属于弱酸 |
| B、某化合物溶于水导电,该化合物一定是电解质 |
| C、NaCl是电解质,食盐的水溶液也是电解质 |
| D、根据电解质在水溶液中的电离程度,将电解质分为强电解质和弱电解质 |
下列属于糖类的物质有( )
| A、蛋白质 | B、葡萄糖 |
| C、麦芽糖 | D、纤维素 |
某市以保护环境和垃圾资源化为目的,将城市生活垃圾进行分类.下列垃圾属于同类物质的是 ( )
| A、废电池、易拉罐 |
| B、废铜烂铁、塑料袋 |
| C、旧报纸、硬纸板 |
| D、包装塑料、啤酒瓶 |
已知反应3Cu+8HNO3(稀)═Cu(NO3)2+2NO↑+4H2O.当生成2molNO时,下列说法正确的是( )
| A、有2molHNO3被还原 |
| B、转移的电子数目为6mol |
| C、有8molHNO3参加反应 |
| D、HNO3只作氧化剂 |
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、101kPa下△H=-113kJ?mol-1,△S=-145J?mol-1?K-1.下列说法中不正确的是( )
| A、该反应中反应物总能量高于生成物的总能量 |
| B、该反应只能在较高温度下才能自发进行 |
| C、汽车尾气中的这两种气体均会与人体血红蛋白结合而使人中毒 |
| D、该反应在较低温度下能自发进行,高温和催化剂条件只是加快反应的速率 |
下列离子方程式正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B、氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、稀盐酸滴在石灰石上:CaCO3+2H+=Ca2++H2CO3 |
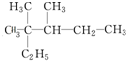
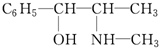 麻黄素中含氧官能团的名称是
麻黄素中含氧官能团的名称是