题目内容
下列有关实验的说法正确的是( )
| A、加入Cu粉可以除去FeSO4溶液中的Fe2(SO4)3 |
| B、取少量溶液X,向其中加入适量新制氯水,再加入几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、用容量瓶配制1.00mol/L的NaOH溶液,定容时俯视刻度线,会使配出的溶液浓度偏大 |
| D、由于SiO2能与NaOH溶液反应,故NaOH溶液不能用玻璃瓶瓶盛放 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.Cu与硫酸铁反应生成硫酸亚铁和硫酸铜;
B.加入适量新制氯水,可氧化亚铁离子,再加入几滴KSCN溶液,溶液变红;
C.定容时俯视刻度线,溶液体积偏小,结合c=
分析;
D.玻璃中含二氧化硅,二氧化硅与NaOH反应生成具有粘合性的硅酸钠.
B.加入适量新制氯水,可氧化亚铁离子,再加入几滴KSCN溶液,溶液变红;
C.定容时俯视刻度线,溶液体积偏小,结合c=
| n |
| V |
D.玻璃中含二氧化硅,二氧化硅与NaOH反应生成具有粘合性的硅酸钠.
解答:
解:A.Cu与硫酸铁反应生成硫酸亚铁和硫酸铜,引入新杂质,应选铁粉除杂,故A错误;
B.加入适量新制氯水,可氧化亚铁离子,再加入几滴KSCN溶液,溶液变红,不能检验亚铁离子,应先加KSCN溶液无现象,再加氯水检验亚铁离子,故B错误;
C.定容时俯视刻度线,溶液体积偏小,由c=
可知,会使配出的溶液浓度偏大,故C正确;
D.玻璃中含二氧化硅,二氧化硅与NaOH反应生成具有粘合性的硅酸钠,不能使用玻璃瓶塞,但可使用玻璃瓶盛放,故D错误;
故选C.
B.加入适量新制氯水,可氧化亚铁离子,再加入几滴KSCN溶液,溶液变红,不能检验亚铁离子,应先加KSCN溶液无现象,再加氯水检验亚铁离子,故B错误;
C.定容时俯视刻度线,溶液体积偏小,由c=
| n |
| V |
D.玻璃中含二氧化硅,二氧化硅与NaOH反应生成具有粘合性的硅酸钠,不能使用玻璃瓶塞,但可使用玻璃瓶盛放,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、溶液配制及试剂存放等为解答的关键,侧重物质性质及实验基本技能的考查,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列溶液中有关物质的浓度关系正确的是( )
| A、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D、某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-) |
有机物A的结构如图所示,下述正确的是


| A、A的分子式为C17H1803 |
| B、A的水解产物不少能发生聚合反应 |
| C、A不能使KMnO4的溶液褪色 |
| D、1mol与NaOH反应,最多消耗2molNaOH |
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的是( )
A、 用图所示装置可制取Cl2 |
B、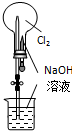 用图所示装置可完成“喷泉”实验 |
C、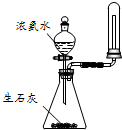 用图所示装置可制取并收集干燥纯净的NH3 |
D、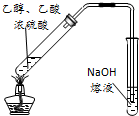 用图所示装置可用于实验室制取乙酸乙酯 |
下列实验合理的是( )
A、 量取500ml盐酸 |
B、 检验Fe2+ |
C、 制乙酸乙酯 |
D、 分离汽油和水 |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH已吸潮 |
| B、容量瓶未干燥 |
| C、烧杯内有少量NaOH溶液残留 |
| D、定容时俯视液面 |
下列关于Na2CO3和NaHCO3的是( )
| A、与足量酸反应:离子方程式相同 |
| B、热稳定性:Na2CO3<NaHCO3 |
| C、常温下在水中的溶解度:Na2CO3>NaHCO3 |
| D、等质量的碳酸钠和碳酸氢钠与足量酸反应产生CO2的质量:Na2CO3<NaHCO3 |
 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A、有O2放电的a极为电池的负极 |
| B、O2-移向电池的正极 |
| C、b极对应的电极反应为2H2-4e-+2O2-═2H2O |
| D、a极对应的电极反应为O2+2H2O+4e-═4OH- |