题目内容
15.已知A、B、C、D、E是短周期的五种元素,它们的原子序数依次增大.A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可两两反应;A与C同主族;B与E同主族;E的单质为淡黄色晶体,易溶于二硫化碳.(1)画出C元素的离子结构示意图
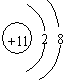
(2)写出C、D的最高价氧化物对应水化物相互反应的离子方程式Al(OH)3+OH-=[Al(OH)4]-
(3)B、C、D、E四种元素的原子半径由大到小的排列顺序为(用元素符号表示)Na>Al>S>O.
分析 A元素原子形成的离子核外电子数为零,则A应为H元素;A与C同主族,则C为Na元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素;B与E同主族,则B为O元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,则D为Al元素,对应的最高价氧化物的水化物是两性氢氧化物,根据元素所在周期表中的位置,结合元素周期律知识解答该题.
解答 解:A元素原子形成的离子核外电子数为零,则A应为H元素;A与C同主族,则C为Na元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,则D为Al元素,对应的最高价氧化物的水化物是两性氢氧化物,
(1)C为Na元素,对应的钠离子原子核内有11个质子,原子核外有10个电子,则其离子结构示意图为: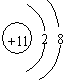 ,
,
故答案为: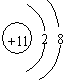 ;
;
(2)D对应的最高价氧化物的水化物是Al(OH)3,具有两性,能与NaOH溶液反应生成[Al(OH)4]-,反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(3)B、C、D、E分别为O、Na、Al、S,原子的电子层越多,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,则四种原子半径大小顺序为:Na>Al>S>O,
故答案为:Na>Al>S>O.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意掌握元素周期表结构、元素周期律内容.

练习册系列答案
相关题目
1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 金属元素和非金属分界线附近的元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 稀有气体元素 |
10.下列反应的离子方程式中,书写正确的是( )
| A. | 氢氧化铜与稀硫酸反应:OH-+H+═H2O | |
| B. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
20.下列各组有机物,不论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗氧气的物质的量和生成水的物质的量分别相等的是( )
| A. | 乙醛和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
7.某原电池总反应的离子方程式是Fe+2Fe3+=3Fe2+,该原电池的组成正确的是( )
| Zn | A | B | C | D |
| 正极 | Fe | C(石墨) | Ag | Zn |
| 负极 | Cu | Fe | Fe | Fe |
| 电解质溶液 | FeCl3 | Fe2 (SO4)3 | H2SO4 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
4.下列气体有颜色的是( )
| A. | C2H4 | B. | Cl2 | C. | NH3 | D. | NO |
5.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
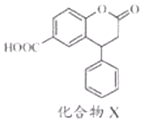

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 1mol化合物X最多可与8molH2发生加成反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
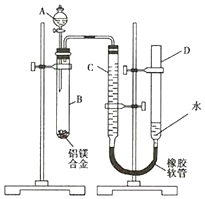 某学习小组用如图装置测定镁铝合金中铝的质量分数.
某学习小组用如图装置测定镁铝合金中铝的质量分数. 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.