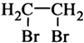题目内容
下列指定反应的离子方程式正确的是( )
| A、FeCl3溶液中加入过量的锌粉:Zn+2Fe3+═Zn2++2Fe2+ | ||||
| B、NH4Al(SO4)2中加入过量的NaOH溶液:Al3++4OH-═AlO2-+2H2O | ||||
| C、(CH3COO)2Ba中加入稀硫酸:Ba2++SO42-═BaSO4↓ | ||||
D、用惰性电极电解Cu(NO3)2溶液:2Cu2++2H2O
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.锌还原性大于铁,在溶液中能够将铁离子还原成铁单质;
B.氢氧化钠过量,铵根离子和铝离子都参与反应;
C.反应生成硫酸钡和醋酸,漏掉了生成醋酸的反应;
D.惰性电极电解硝酸铜溶液,阳极水电离的氢氧根离子放电、阴极铜离子得到电子生成铜.
B.氢氧化钠过量,铵根离子和铝离子都参与反应;
C.反应生成硫酸钡和醋酸,漏掉了生成醋酸的反应;
D.惰性电极电解硝酸铜溶液,阳极水电离的氢氧根离子放电、阴极铜离子得到电子生成铜.
解答:
解:A.FeCl3溶液中加入过量的锌粉,反应生成锌离子和铁单质,正确的离子方程式为:3Zn+2Fe3+═3Zn2++3Fe,故A错误;
B.NH4Al(SO4)2中加入过量的NaOH溶液,铵根离子也参与反应,正确的离子方程式为:Al3++NH4++5OH-═AlO2-+2H2O+NH3?H2O,故B错误;
C.(CH3COO)2Ba中加入稀硫酸,反应生成硫酸钡和醋酸,正确的离子方程式为:2H++Ba2++2CH3COO-+SO42-═BaSO4↓+2CH3COOH,故C错误;
D.用惰性电极电解Cu(NO3)2溶液,反应的离子方程式为:2Cu2++2H2O
2Cu+O2↑+4H+,故D正确;
故选D.
B.NH4Al(SO4)2中加入过量的NaOH溶液,铵根离子也参与反应,正确的离子方程式为:Al3++NH4++5OH-═AlO2-+2H2O+NH3?H2O,故B错误;
C.(CH3COO)2Ba中加入稀硫酸,反应生成硫酸钡和醋酸,正确的离子方程式为:2H++Ba2++2CH3COO-+SO42-═BaSO4↓+2CH3COOH,故C错误;
D.用惰性电极电解Cu(NO3)2溶液,反应的离子方程式为:2Cu2++2H2O
| ||
故选D.
点评:本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;选项C不要漏掉了生成醋酸的反应.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
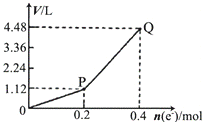 用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol e-时,电解生成的铜为6.4g |
| C、阳极电极反应式为2H2O+4e-=4H++O2↑ |
| D、Q点对应的气体中,H2与O2的体积比为2:1 |
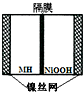 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池 (MH-Ni碱性电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- |
| B、放电时负极反应为:MH+OH--2e-=H2O+M+ |
| C、充电时氢氧根离子移向阳极,要参与电极反应 |
| D、充电时电池的正极连接直流电源的正极,得到电子发生还原反应 |
分析以下几个热化学方程式,能表示燃烧热的是( )
| A、C(s)+O2(g)═CO(g)△H=-110.5 kJ/mol | ||
| B、C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol | ||
| C、2H2 (g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | ||
D、H2(g)+
|
下列变化需要加入还原剂才能实现的转化是( )
| A、Fe2+→Fe3+ |
| B、H2SO4→SO2 |
| C、H2S→SO2 |
| D、HCO3-→CO2 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、28g氮气所含有的原子数目为NA |
| B、化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| C、标准状况下,22.4L水中含有个水分子NA |
| D、标准状况下,22.4L氯化氢所含的原子数为NA |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、4.6g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、标准状况下,1.12LCCl4含有C-Cl键的数目为0.2NA |
| D、将0.1mol FeCl3溶于 1L水中,所得溶液中含有0.1NA个Fe3+ |
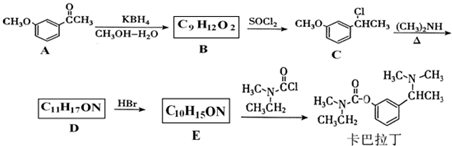
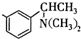 基团 ②属于α-氨基酸 ③含有三个手性碳原子.
基团 ②属于α-氨基酸 ③含有三个手性碳原子.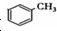 )和丙酮(
)和丙酮(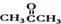 ) 制备化合物
) 制备化合物 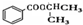 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH